题目内容
【题目】下列有关化学平衡常数K的说法中,正确的是
A. K的大小与起始浓度有关
B. 温度越高,K值越大
C. K值越大,反应正向进行的程度越大
D. K值越大,反应正向进行的程度越小
【答案】C
【解析】
A.平衡常数K只与温度有关,反应浓度、压强不影响化学平衡常数,故A错误;
B.温度升高,K值可能增大,也可能减小,若为放热反应,升高温度,平衡逆向移动,K值减小,B错误;
C.平衡常数K的大小可以推断一个反应进行的程度,K值越大,反应正向进行的程度越大,故C正确;
D. 平衡常数K的大小可以推断一个反应进行的程度,K值越大,反应正向进行的程度越大,故D错误;
答案选C。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
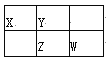
【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1) X在元素周期表中的位置为_______;画出X的简单离子结构示意图_______。
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_____________。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为_______>________(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为______ 。
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。