题目内容
在四个不同容器中且不同条件下进行N2 + 3H2 2NH3反应,根据在相同时间内测定的结果判断生成氨的速率最快的是( )
2NH3反应,根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A.V(NH3)=0.5 mol •L-1-•min-1 B.V(H2)=0.02mol •L-1-• s -1
C.V(N2)=0.2 mol •L-1-•min-1 D.V(H2)=0.3 mol •L-1-•min-1
B
【解析】同一反应用不同的物质表示其反应速率时数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时需要换算成用同一种物质来表示,然后才能直接比较其快慢。若都用氢气表示其反应速率,则分别为0.75 mol •L-1-•min-1、1.2 mol •L-1-•min-1、0.6 mol •L-1-•min-1、0.3 mol •L-1-•min-1,因此答案是B。

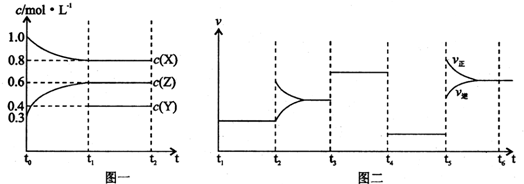
| A、Y的起始物质的量为1.0 mol | ||||
| B、t4-t5阶段改变的条件为减小压强;t5-t6是升高温度 | ||||
| C、此温度下该反应的化学方程式为2X(g)+Y(g)?2Z(g) | ||||
D、在相同条件下,若起始时容器中加入a mol X b mol Y和c mol Z,要达到t1时刻同样的平衡,a,b,c要满足的条件为a+
|
向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应: 2X(g)  Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min 后反应达到平衡 , 此时测得容器内的压强为起始时的1.2倍, 则用Y表示的速率为 mol/(L·min);
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)="3.5" mol/(L·min); 乙:v(Y)="2" mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)="0.075" mol/(L·s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) ;
(3)若向达到(1)的平衡体系中充入氮气,则平衡向 (填"左"或"右"或"不)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填“左”或“右”或“不”)移动;
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体 , 则平衡后X 的转化率与(1)的平衡中X的转化率相比较:
| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
(6)若保持温度和体积不变,起始时加入X、Y、Z 物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 。
(9分) 向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。
一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。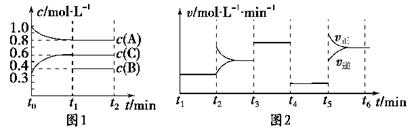
(1)若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=________。
(2)t4-t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:________________________。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为________。

 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol