��Ŀ����
��Ԫ�����ڱ�������Ԫ���У�A��B��C��M�ǵ��ʡ�M��һ���ճ����ý������й�ת����ͼ��

��ش�
��1��Ԫ��M��Ԫ�����ڱ���λ�ã� ���ڣ� ���塣
��2����д��B��C�ڼ��������·�Ӧ�Ļ�ѧ����ʽ��
�� C��D��Ӧ�Ļ�ѧ����ʽΪ��
��д��M��F��ˮ��Һ��Ӧ�����ӷ���ʽ��
��3����1mol E��1mol̼�����ƻ�Ϸ����ܱ������м��ȣ�������300�澭��ַ�Ӧ���ų����塣
���
�������ڲ����Ĺ����������Ƽ������ʵ��� ��
���������з����Ļ�ѧ��Ӧ�Ļ�ѧ����ʽ�� ��
��15�֣�
��1��������A����1�֣�
��2��2Na+O2 Na2O2��2�֣� 2Na+2H2O=2NaOH+H2����2�֣�
��3��2Al+2OH��+2H2O 2AlO2��+3H2����2�֣�
��4��̼���ƣ�1�֣���1mol��1�֣����������ƣ�1�֣� 1mol��1�֣�
2NaHCO3Na2CO3+H2O��+CO2�� 2Na2O2+2CO2
2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2��ÿ��1�֣�
����:һ��Ҫע�Ȿ�����漰��Ԫ�ؾ�Ϊ������Ԫ�أ�M��һ���ճ����ý�������֪MΪ�������͵���B�ɷ�Ӧ������B�Ļ����P���ʣ��ɲ²�BΪ������������֪D��E�ֱ�����A��C��������Ӧ�õ�����Ϊ�������ҿɷ�Ӧ�������������Ʋ��D��EӦ����Na2O2��CO2��Na2O2��H2O������D��E�IJ���F��������Ӧ��֪D��EӦ����Na2O2��H2O��Ӧ������F��NaOH����F��NaOH����M��������Ӧ������A��H����֪AΪ������
����Ϊֹ����֪A��B��C�ֱ�Ϊ�������������Ƶ��ʡ�
��3����1mol Na2O2��1mol̼�����ƻ�Ϸ����ܱ������м��ȣ��������з�Ӧ��
2NaHCO3Na2CO3+H2O��+CO2��
2Na2O2+2CO2 2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2��ÿ��1�֣�
NaHCO3�ֽ��������������ǡ����Na2O2��Ӧ������Ӧ�IJ��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�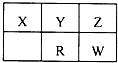 ������Ԫ��X��Y��Z��R��W��Ԫ�����ڱ���λ����ͼ��ʾ������WԪ����������������������2����������˵����ȷ���ǣ�������
������Ԫ��X��Y��Z��R��W��Ԫ�����ڱ���λ����ͼ��ʾ������WԪ����������������������2����������˵����ȷ���ǣ�������| A��ԭ�Ӱ뾶��С����X��Y��R��W | B��Z��WԪ����X�������γ�AB2�ͻ����� | C��X�ж���ͬ�������壬��Z������ͬ�������� | D��Z���⻯���ȶ��Դ���W���⻯���ȶ��ԣ�����ΪZ���⻯����Ӽ������� |
����Ԫ������Ԫ���й�������������е�X�DZ�ʾԪ��ԭ���ڷ��������յ��������Ĵ�С��XԽ��ԭ���������ӵ�����Խǿ�������ֵΪ4.0����Сֵ��0.7���Իش��������⣺
| Ԫ�ر�� | A | B | C | D | E |
| X | 3.5 | 3.0 | X3 | 1.5 | 1.5 |
| ��Ҫ���ϼ� | -2 | +7 | +6 | +3 | +2 |
��1��X3��ֵӦ��Ϊ�� ��
A��3.6 B��3.1 C��2.5 D��1.4
��2��EԪ����Ԫ�����ڱ��е�λ���� ��BԪ�ص��ʵĵ���ʽΪ ��
��3��AԪ�ص�ԭ������ ��δ�ɶԵ��ӡ�A��B��CԪ���γɵĵ����У��ṹ������������ǿ���� ��д�������ƣ���
��4����һ����ѧ��Ӧ����֤��B��C�ǽ����Ե�ǿ����д���÷�Ӧ�Ļ�ѧ����ʽ��
��
��һ����ѧ��ӦҲ����֤��DԪ�غ���DԪ��ͬ������ԭ�Ӱ뾶����Ԫ�أ������壩�Ľ����Ե�ǿ����д���÷�Ӧ�����ӷ���ʽ��
��
��14�֣�X��Y��Z��W��Q��ԭ��������������Ķ���������Ԫ�أ������Ϣ���±���
|
Ԫ �� |
�����Ϣ |
|
X |
Xԭ�Ӻ��������������Ǵ�����2�� |
|
Y |
Y����̬�⻯���ˮ��Һ�������� |
|
Z |
Z�ǵؿ��к������Ľ���Ԫ�� |
|
W |
���³�ѹ�£�W�ĵ����ǵ���ɫ���� |
|
Q |
���� |
����������Ϣ�ش��������⣺
(1)Ԫ��Q��Ԫ�����ڱ��е�λ��______________________________��
(2)Y�������̬�⻯���ˮ��Һ����H2O2������Ӧ������ﲻ��Ⱦ��������ѧ����ʽΪ______________________________________������Ԫ�ط��ű�ʾ����ͬ��
(3)X����Ԫ����ɵĻ����������6��ԭ�ӣ���ṹʽΪ ��
(4)��֪��X(s)+O2(g) =XO2(g) ��H = -393.5��J��mol-1
2X(s)+O2(g) =2XO(g) ��H = -221.0��J��mol-1
��XO��ȼ���ȵ��Ȼ�ѧ����ʽ__________________________________________________.
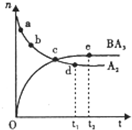
(5)Ԫ��Y����Ԫ���γɵ�����������ң����Һ�Z�������ӵĻ����Һ�м������Na2O2�� ����Na2O2�����ʵ����������������ͼ��ʾ��ϵ��

д���йط�Ӧ���ӷ���ʽ��(ÿ��ֻ��һ�����ӷ���ʽ��ʾ)
o��a��
a��b�� ��
 A��B��C��D��E��F����Ԫ�ط������������ڣ���ԭ��������������A��ԭ�������ڱ��а� ����С��A��D�����壬���γ����ӻ�����DA��C��Fͬ���壬���γ�FC2��FC3���ַ���B��D��E ���ߵ�����������Ӧ��ˮ��������֮����ɷ�Ӧ���ɿ������κ�ˮ���������о���CԪ �أ�����д���пհף�
A��B��C��D��E��F����Ԫ�ط������������ڣ���ԭ��������������A��ԭ�������ڱ��а� ����С��A��D�����壬���γ����ӻ�����DA��C��Fͬ���壬���γ�FC2��FC3���ַ���B��D��E ���ߵ�����������Ӧ��ˮ��������֮����ɷ�Ӧ���ɿ������κ�ˮ���������о���CԪ �أ�����д���пհף�