题目内容
【题目】【化学—选修2:化学与技术】利用天然气合成氨的工艺流程示意如下,完成下列填空:
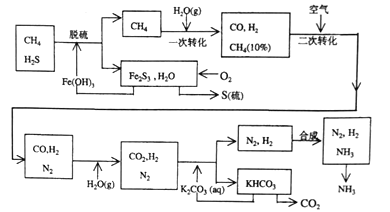
(1)天然气脱硫采用了Fe(OH)3,Fe(OH)3可以再生循环,可以再生循环.写出上述工艺中由Fe2S3再生Fe(OH)3的化学方程式是 。含硫化合物遇到Fe3+的反应情况与反应条件有关.以NaHS溶液与FeCl3溶液混合为例:将溶液置于80°C的热水浴中,发现有红褐色沉淀生成,写出该反应的化学方程式: 。解释该反应在温度升高后能发生,而低温时不易发生的原因 。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2___mol(用含n的代数式表示)
(3)K2CO3和CO2又反应在加压下进行.加压的理论依据是 (多选扣分)
a.相似相溶原理
b.勒夏特列原理
c.艘喊中和原理
(4)整个流程有兰处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,还有一处循环未标明.请指出上述流程图中第三处循环的物质是 ·
(5)工业上制取的硝酸铵的流程图如下.请回答下列问题:
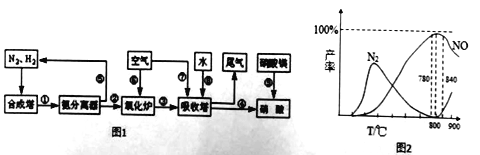
据图2可知工业上氨催化氧生成NO时.应该控制温度在 左右.其中在吸收塔中为了尽可能提高硝酸的产率,减少尾气排放.常常调节空气与NO的比例.写出吸收塔内发生反应的总化学方程式为 。
【答案】(1)2Fe2S3+6H2O+3O2 =6S+4Fe(OH)3 (2分;物质书写正确得1分,配平1分。任一物质有错误得0分。下同)FeCl3+3NaHS+3H2O=Fe(OH)3↓+3H2S↑+3NaCl(写成可逆符号也给分) (2分)
水解是吸热反应(1分),温度升高,平衡向吸热反应方向进行,所以高温该反应容易发生(1分)(若回答温度升高,H2S逸出,平衡正向移动只能得1分)
(2)2.7n (2分) (3)b (2分,多选一个倒扣1分,扣完为止。若写成B不给分)
(4)N2和H2(2分,一个1分,若多写倒扣1分,扣完为止)
(5)800℃(1分,790℃到800℃范围内任一温度都得1分)
【解析】
试题分析:(1)由Fe2S3再生Fe(OH)3的化学方程式是2Fe2S3+6H2O+3O2 =6S+4Fe(OH)3;将溶液置于80°C的热水浴中,发现有红褐色沉淀生成,说明生成了氢氧化铁,写出该反应的化学方程式:FeCl3+3NaHS+3H2O=Fe(OH)3↓+3H2S↑+3NaCl;水解是吸热反应(1分),温度升高,平衡向吸热反应方向进行,所以高温该反应容易发生。
(2)据题意得反应方程式为:CH4+H2O=CO+3H2,当生成0.9nmolCO时,同时生成2.7nmol氢气。
(3)碳酸钾与二氧化碳反应生成碳酸氢钾,属于气体系数减小的反应,据勒夏特列原理,加压有利于反应正向进行。
(4)流程图中加入空气是利用其氮气和氢气,而反应过程中又生成氮气和氢气,故它们也可循环利用。
(5)据图2得要生成NO尽量多氮气尽量少应控制在790℃到800℃范围内。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)下列事实能证明②的非金属性比⑦强的是 。
A.Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C![]() Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O = H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有_________________。
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:______。(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
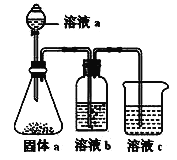
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系。
①溶液a和b分别为_______________,_______________。
②溶液c中的离子方程式为______________________。

