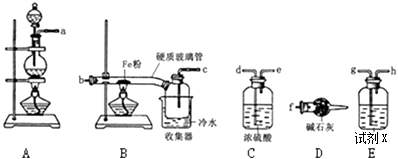
题目内容
【题目】下列离子方程式书写正确的是
A.碳酸钠与足量盐酸反应:CO32-+2H+=H2O + CO2↑
B.铁粉与稀硫酸反应:Fe+6H+=2Fe3++3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl+OH-=H2O+Cl-
D.稀硝酸滴在石灰石上:CO32-+2H+=H2O+CO2↑
【答案】A
【解析】
A.Na2CO3和HCl均为强电解质,离子方程式中可以拆分;此外,足量的盐酸会与碳酸钠反应生成CO2气体,故A项正确;
B.稀硫酸与Fe反应只能生成Fe2+,B 项错误;
C.HCl为强电解质,离子方程式中需要拆分成离子,C项错误;
D.石灰石的成分主要是CaCO3,是难溶物,离子方程式中不可以拆分,所以D项错误;
答案选A。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用下图装置进行中和热的测定,请回答下列问题: 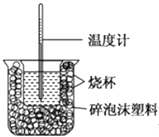
(1)该图中有两处未画出,它们分别是、 .
(2)做一次完整的中和热测定实验,温度计需使用次.
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 13 | 19.8 | △H1 |
HCl+NH3H2O | 13 | 19.3 | △H2 |
①比较△H1和△H2的相对大小:△H1△H2(填“>”“<”或“=”).
②两组实验结果差异的原因是 .
③写出HCl和NH3H2O反应的热化学方程式: .