题目内容
向铜片中加某浓度的硫酸120 mL,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500 mL,再加入足量锌粉,使之充分反应收集到标准状况下气体2.24 L,过滤残留固体,干燥后称量,质量减轻了7.5 g,求原硫酸的物质的量浓度。
17.5 mol·L-1
Zn + H2SO4(稀)====ZnSO4+H2↑
0.1 mol 0.1 mol 0.1 mol
Zn与CuSO4反应固体质量减轻:
7.5 g-0.1 mol×65 g·mol-1="1.0" g
Zn+CuSO4====ZnSO4+Cu Δm(固)
65 g 1 mol 64 g 1.0 g
Cu+2H2SO4(浓)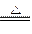 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2 mol 1 mol
c(H2SO4)=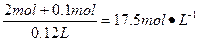 。
。
0.1 mol 0.1 mol 0.1 mol
Zn与CuSO4反应固体质量减轻:
7.5 g-0.1 mol×65 g·mol-1="1.0" g
Zn+CuSO4====ZnSO4+Cu Δm(固)
65 g 1 mol 64 g 1.0 g
Cu+2H2SO4(浓)
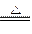 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O2 mol 1 mol
c(H2SO4)=
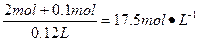 。
。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目