题目内容
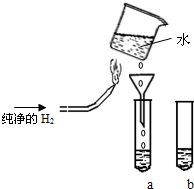 某实验探究小组进行氢气在空气中燃烧的实验探究,装置如图所示(固定装置略去),在试管a和b中分别装入少量下表溶液进行实验:
某实验探究小组进行氢气在空气中燃烧的实验探究,装置如图所示(固定装置略去),在试管a和b中分别装入少量下表溶液进行实验:
| 实验 | 试管a | 试管b(作对比用) | 试管a中实验现象 |
| ① | KI-淀粉溶液 | KI-淀粉溶液 | 溶液变蓝色 |
| ② | 酸性高锰酸钾稀溶液 | 酸性高锰酸钾稀溶液 | 溶液紫红色褪去 |
- A.热水可使KI-淀粉溶液和酸性高锰酸钾溶液变色
- B.H2在空气中燃烧可能有H2O2生成
- C.用H2燃烧产生的热来加热水
- D.对燃烧产生的水进行过滤
B
分析:根据实验现象:试管a中的KI-淀粉溶液变蓝色和酸性高锰酸钾稀溶液的紫红色褪去,说明燃烧产物中含有既能使I-氧化为I2又能使MnO4-/H+还原的物质,这种物质可能是H2O2.
解答:根据实验现象:试管a中的KI-淀粉溶液变蓝色和酸性高锰酸钾稀溶液的紫红色褪去,说明燃烧产物中含有既能使I-氧化为I2又能使MnO4-/H+还原的物质,这种物质可能是
H2O2.
发生的反应为:H2O2+2I-+2H+═I2+2H2O,5H2O2+2MnO4-+6H+═2Mn2++5O2↑+8H2O.事实上,氢气和氧气在点燃条件下的反应是链式反应,反应过程中有H、O和OH自由基产生,有可能产生2HO═H2O2,H2O+O═H2O2.
故选:B.
点评:考查学生对实验方案设计的理解、元素化合物性质等,难度中等,是对所学知识的综合考查.根据实验选项选项判断氢气燃烧的可能产物是关键.
分析:根据实验现象:试管a中的KI-淀粉溶液变蓝色和酸性高锰酸钾稀溶液的紫红色褪去,说明燃烧产物中含有既能使I-氧化为I2又能使MnO4-/H+还原的物质,这种物质可能是H2O2.
解答:根据实验现象:试管a中的KI-淀粉溶液变蓝色和酸性高锰酸钾稀溶液的紫红色褪去,说明燃烧产物中含有既能使I-氧化为I2又能使MnO4-/H+还原的物质,这种物质可能是
H2O2.
发生的反应为:H2O2+2I-+2H+═I2+2H2O,5H2O2+2MnO4-+6H+═2Mn2++5O2↑+8H2O.事实上,氢气和氧气在点燃条件下的反应是链式反应,反应过程中有H、O和OH自由基产生,有可能产生2HO═H2O2,H2O+O═H2O2.
故选:B.
点评:考查学生对实验方案设计的理解、元素化合物性质等,难度中等,是对所学知识的综合考查.根据实验选项选项判断氢气燃烧的可能产物是关键.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验
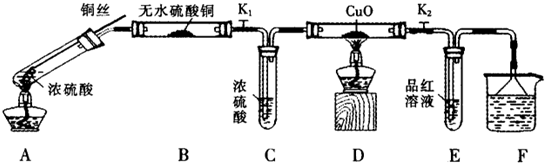
(1)F烧杯中的溶液是 .
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 .
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 .
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 .
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为 .
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种.
仅由上述资料可得出的正确结论是 .
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为 .
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验

(1)F烧杯中的溶液是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
仅由上述资料可得出的正确结论是
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
 如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题: 某校学习小组进行下述实验探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).
某校学习小组进行下述实验探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).

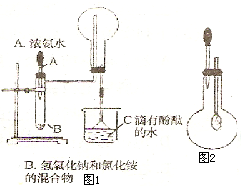 如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸人约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴人试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸人2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴人烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸人约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴人试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸人2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴人烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题: NH3↑+H2O;⑤NH4Cl会分解释放出NH3.
NH3↑+H2O;⑤NH4Cl会分解释放出NH3.