题目内容
6. 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾霾形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾霾形成的原因.(1)汽车尾气净化的主要原理为;2N0(g)+2C0(g)$\stackrel{催化剂}{?}$N2(g)+2C02(g)△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是CD.
A.在单位时间内生成1mol CO2的同时消耗了lmol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
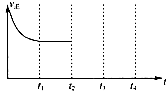
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
③若要同时提高该反应的速率和NO的转化率,采取的措施有增大压强、向容器中充入CO气体.(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3•mol-1
①该反应在高温下能自发进行(填“高温”或“低温,’).
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-.(已知:H2S:Ka1═9.1×10-18;Ka2═1.1×10-12,H2CO3:Ka1═4.3×10-7;Ka2═5.6×10-11.)
(3)已知反应:CO(g)+H20(g)?CO2(g)+H2(g),现将不同量的CO(g)和H20(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b.
③该反应的△H<0(填“<”或“>”);若在9000C时,另做一组实验,在此容器中加人l0mol C0,5mo1H20,2mo1C02,5mol H2,则此时V正<V逆(填“<”,“>”,“=”).
分析 (1)①A.在单位时问内生成1mol CO2的同时消耗了1mol CO,从反应开始到平衡,都符合这等量关系;
B.混合气体的密度不再改变,体积不变,反应体系都是气体,从反应开始到平衡,密度始终不变;
C.混合气体的平均相对分子质量不再改变,说明各物质的物质的量不变,达平衡状态;
D:混合气体的压强不再变化,说明各物质的物质的量不变,达平衡状态;
②将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,相当于减小压强,正逆反应速率都比原来的小,平衡逆向移动,所V正<V逆;
③若要同时提高该反应的速率和NO的转化率,外界条件增强,平衡正向移动;
(2)①根据△G=△H-T△S判断,△G<0,反应自发进行;
②根据碳酸和氢硫酸的两步电离平衡常数进行比较氢硫酸与碳酸、碳酸氢根离子离子酸性大小,从而得出反应产物,写出反应的离子方程式;
第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;依据图表数据列式计算平衡浓度,结合(3)①根据平衡常数的表达式进行计算;
②如果a=b两者的转化率相等,CO的转化率大于水蒸气,相当于加入水蒸气,平衡正向移动;
③利用实验1与实验2温度变化比较平衡常数来判断反应热,依据浓度商和平衡常数比较分析判断.
解答 解:(1)①A.在单位时问内生成1mol CO2的同时消耗了1mol CO,从反应开始到平衡,都符合这等量关系,故A不选;
B.混合气体的密度不再改变,体积不变,反应体系都是气体,从反应开始到平衡,密度始终不变,故B不选;
C.混合气体的平均相对分子质量不再改变,说明各物质的物质的量不变,达平衡状态,故C选;
D:混合气体的压强不再变化,说明各物质的物质的量不变,达平衡状态,故D选;
故答案为:CD;
②将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,相当于减小压强,正逆反应速率都比原来的小,平衡逆向移动,所V正<V逆,故图象为: ,故答案为:
,故答案为: ;
;
③若要同时提高该反应的速率和NO的转化率,外界条件增强,平衡正向移动,措施是增大压强或向容器中充入CO气体,
故答案为:增大压强;向容器中充入CO气体;
(2)①由热化学反应方程式可知,该反应为焓增、熵增过程,即△H>0、△S>0,必须满足△G=△H-T△S<0反应才能自发进行,所以在高温下能够自发进行,
故答案为:高温;
②由于Ka2=5.61×10-11<Ka1=9.1×10-8<Ka1=4.30×10-7、Ka2=5.61×10-11>Ka2=1.1×10-12,所以氢硫酸能够与碳酸钠溶液反应生成碳酸氢钠和硫氢化钠,反应的离子方程式为:CO32-+H2S=HCO3-+HS-,
故答案为:CO32-+H2S=HCO3-+HS-;
(3)①验1计算平衡常数,
H2O(g)+CO(g)?CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
转化 0.8mol/L 0.8mol/l 0.2mol/l 0.2mol/l
平衡 0.2mol/L 1.2mol/L 0.2mol/l 0.2mol/l
K=$\frac{0.8×0.8}{0.2×1.2}$=2.67,
故答案为:2.67;
②如果a=b两者的转化率相等,CO的转化率大于水蒸气,相当于加入水蒸气,平衡正向移动,则a<b,
故答案为:a<b;
③则实验1升高温度实验2,验2计算平衡常数,
H2O(g)+CO(g)?CO2(g)+H2(g)
初始 0.5mol/L 1mol/L 0 0
转化 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{0.2×0.2}{0.3×0.8}$=0.167,温度升高K变小,温度升高平衡向逆反应方向移动,正反应为放热反应,
按10mol C0,5mol H20,2mol C02,5mol H2,分别加入该容器
Qc=$\frac{2×5}{10×5}$=0.2>K
反应逆向进行,v(正)<v(逆),
故答案为:<;<.
点评 本题考查化学平衡和化学反应速率等知识,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,此为化学平衡常考查问题.

 口算题天天练系列答案
口算题天天练系列答案| A. | 铁丝在氧气中燃烧:火星四射,生成红色固体 | |
| B. | 硫粉在空气中燃烧:产生淡蓝色火焰,生成一种刺激性气味的气体 | |
| C. | 镁条在空气中燃烧:发出耀眼的白光,只生成一种黑色固体 | |
| D. | 红磷在空气中燃烧:发出白光,生成大量的白色烟雾 |
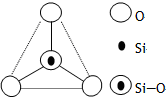 如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )
如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )| A. | 键角为120℃ | B. | 化学组成为SiO32- | ||
| C. | 键角为60° | D. | 化学组成为SiO44- |
| A. | ls22s22p63s23p5 | B. | 1s22s22p63s23p2 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
 ②N2
②N2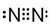 ③H2O
③H2O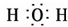 .
.
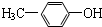 ;
;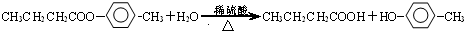 ;
;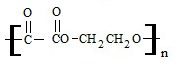 +2nH2O.
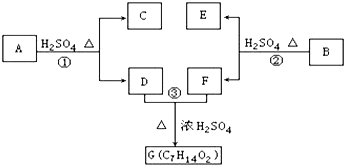
+2nH2O.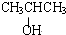 ;写出生成G的化学方程式CH3CH2CH2COOH+
;写出生成G的化学方程式CH3CH2CH2COOH+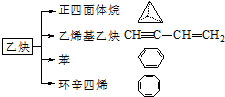 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.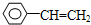 .
.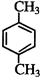 、
、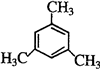 .
. ,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$
,试写出有关化学反应方程式:CH≡CH+HCl$→_{△}^{催化剂}$CH2=CHCl,nCH2=CHCl$\stackrel{一定条件}{→}$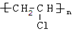 .
.