题目内容
化学键的键能是指气态原子间形成1mol化学键时释放的能量.如H(g)+I(g)═H-I(g)△H=-297kJ/mol,即H-I键的键能为297kJ/mol,也可以理解为破坏1mol H-I键需要吸收297kJ的能量.一个化学反应一般有旧化学键的断裂和新化学键的形成.如表是一些键能数据(kJ/mol):
回答下列问题:
(1)由表中数据能否得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大) (填“能”或“不能”);
②非金属性越强的原子形成的共价键越牢固 (填“能”或“不能”).能否由数据找出一些规律,请写出一条: ;试预测C-Br键的键能范围: <C-Br键能< .
(2)由热化学方程式H2(g)+Cl2(g)═2HCl(g)△H=-183kJ/mol,并结合表上数据可推知一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物的键能之间的关系是 .
由热化学方程式2H2(g)+S2(s)═2H2S(g)△H=-224.5kJ/mol和表中数值可计算出1mol S2(s)汽化时将 (填“吸收”或“放出”) kJ的热量.
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 431 | H-O | 464 |
| S═S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
(1)由表中数据能否得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大)
②非金属性越强的原子形成的共价键越牢固
(2)由热化学方程式H2(g)+Cl2(g)═2HCl(g)△H=-183kJ/mol,并结合表上数据可推知一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物的键能之间的关系是
由热化学方程式2H2(g)+S2(s)═2H2S(g)△H=-224.5kJ/mol和表中数值可计算出1mol S2(s)汽化时将
考点:键能、键长、键角及其应用
专题:
分析:(1)比较半径与键能大小要在同一标准下进行,否则没有可比性,同主族元素的半径越大,键能越小;
(2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,可以此来书写热化学方程式并计算反应热;
(2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,可以此来书写热化学方程式并计算反应热;
解答:
解:(1)由表中数据可知,原子半径F>H,但键能:H-F>H-H,则不能得出半径越小的原子形成的共价键越牢固的结论,Cl的非金属性大于H,但键能H-H>Cl-Cl,也不能说明非金属性越强的原子形成的共价键越牢固,由H-F、H-Cl、H-Br、H-I的键能可以看出,与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;Br的原子半径介于Cl与I之间,C-Br的键能介于C-Cl与C-I之间,即218KJ?mol-1~330 KJ?mol-1之间,
故答案为:①不能;②不能;与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;218KJ?mol-1、330 KJ?mol-1;
(2)已知:热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ?mol-1,
可得出△H=436kJ/mol+243kJ/mol-2×432kJ/mol=-185kJ/mol,则有化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,
由表中数据可得:2H2(g)+S2(g)→2H2S(g);△H=-229KJ?mol-1,
又知2H2(g)+S2(s)→2H2S(g);△H=-224.5KJ?mol-1,则S2(s)→S2(g);△H=+4.5kJ/mol,1mol S2(s)气化时将吸收4.5kJ的能量,
故答案为:化学反应的反应热等于反应物的键能之和与生成物的键能之和的差;吸收;4.5;
故答案为:①不能;②不能;与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;218KJ?mol-1、330 KJ?mol-1;
(2)已知:热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ?mol-1,
可得出△H=436kJ/mol+243kJ/mol-2×432kJ/mol=-185kJ/mol,则有化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,
由表中数据可得:2H2(g)+S2(g)→2H2S(g);△H=-229KJ?mol-1,
又知2H2(g)+S2(s)→2H2S(g);△H=-224.5KJ?mol-1,则S2(s)→S2(g);△H=+4.5kJ/mol,1mol S2(s)气化时将吸收4.5kJ的能量,
故答案为:化学反应的反应热等于反应物的键能之和与生成物的键能之和的差;吸收;4.5;
点评:本题考查新信息数据处理能力,断裂化学键难易与形成化学键的两个原子的性质有关,比较时要选择同一标准,否则不可比,依题意,C-Br键能介于C-I、C-Cl键能之间.根据反应的数据得出根据键能计算反应的规律,再运用这一规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列表示物质组成和结构的化学用语中,不正确的是( )
| A、乙炔的结构简式:CHCH |
B、一氟甲烷的电子式: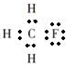 |
| C、聚丙烯的最简式:CH2 |
| D、次氯酸的结构式:H-O-Cl |
已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应.实验时C中粉末逐渐变为红色,D中出现无色液体.下列有关说法正确的是( )
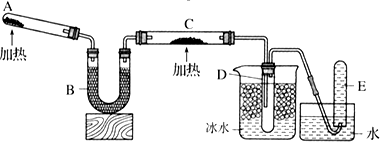

| A、反应中氧化剂和还原剂的物质的量之比为2:3 |
| B、装置B中加入的物质可以是碱石灰或无水氯化钙 |
| C、装置D中液体可以使干燥的红色石蕊试纸变蓝 |
| D、为防止装置D中发生倒吸,可以改用向下排空气法收集氮气 |