题目内容
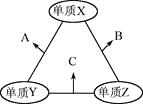
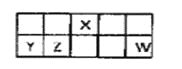
【题目】短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:
(1)写出W的离子结构示意图________________
(2)比较W 与Z的最高价氧化物对应水化物酸性的强弱 (写化学式)
(3)写出X的氢化物的电子式 ,写出X氢化物的水溶液与X的最高价氧化物对应的水化物的水溶液反应的离子方程式_____________________
(4)已知:①C(s)+ O2(g)= CO2(g) △H="a" kJ· mol-1;
②CO2(g) +C(s)="2CO(g)" △H="b" kJ· mol-1;
③Si(s)+ O2(g)=SiO2(s) △H="c" kJ· mol-1。写出工业生产中用碳粉还原二氧化硅制取粗硅的热化学方程式_________________________;
【答案】(1) (2)HClO4>H2SiO3
(2)HClO4>H2SiO3
(3)![]() NH3·H2O+H+=NH4++H2O
NH3·H2O+H+=NH4++H2O
(4)2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1
【解析】试题分析:短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,Y所处的周期序数与族序数相等,短周期元素,则Y为第三周期第ⅢA族元素,即Y为Al,由元素的位置可知,Z为Si,X为N,W为Cl;
(1)Cl原子的核电荷数为16,则Cl-的离子结构示意图为 ;
;
(2)Cl的非金属性比Si强,则最高价氧化物对应水化物酸性的强弱HClO4>H2SiO3;
(3)N的氢化物为NH3,其电子式为![]() ;NH3水溶液与N的最高价氧化物对应的水化物HNO3的水溶液反应生成硝酸铵的离子方程式为NH3·H2O + H+= NH4++ H2O;
;NH3水溶液与N的最高价氧化物对应的水化物HNO3的水溶液反应生成硝酸铵的离子方程式为NH3·H2O + H+= NH4++ H2O;
(4)已知①C(s)+O2(g)=CO2(g) △H=akJ·mol-1;
②CO2(g)+C(s)=2CO(g) △H=bkJ·mol-1;
③Si(s)+O2(g)=SiO2(s) △H=ckJ·mol-1,根据盖斯定律可知①+②-③可得
2C(s)+SiO2(s)=Si(s)+2CO(g),此反应的△H=(a+b-c)kJ·mol-1,
热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1。

 优加精卷系列答案
优加精卷系列答案