题目内容
【题目】工业废水中含有流失的生产用料、中间产物和产品,以及生产过程中产生的污染物.随着工业的迅速发展,废水的排放量迅速增加,严重威胁人类的健康和安全,工业废水的处理比城市污水的处理更为重要.图是含铬工业废水和含氰废水的处理流程: 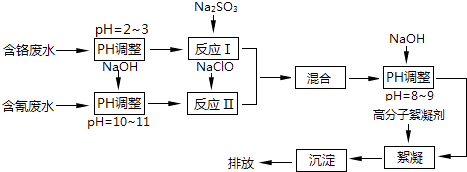
请回答下列问题:
(1)电镀废水中的铬主要以CrO42﹣形式存在,其中Cr元素的化合价为 .
(2)酸性条件下,CrO42﹣极易被还原剂还原为毒性较小的Cr3+ . 图中“反应Ⅰ”的离子方程式为 .
(3)pH>10时,“反应Ⅱ”中的NaClO可快速地将氰离子(CN﹣)氧化为无毒的两种物质,这两种物质是、(写化学式);若pH<8.5,则生成剧毒的CNCl气体(沸点13.1℃),写出该反应的离子方程式 .
(4)经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合的目的是 .
(5)含氰废水及含铬废水可以通过电化学的方法进行无害化处理. ①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应是 .
②电解法处理酸性含铬废水(若铬元素以Cr2O72﹣形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.则阳极的电极反应式为 , 当有1mol Cr2O72﹣被还原时,电路中转移的电子为mol.
【答案】
(1)+6
(2)2CrO42﹣+3SO32﹣+10H+=2Cr3++3SO42﹣+5H2O
(3)N2|CO32|CN﹣+ClO﹣+H2O=CNCl+2OH﹣
(4)使两个反应中过量的氧化剂和还原剂反应;以及发生中和反应
(5)2 CN﹣+12OH﹣﹣10e﹣=2 CO32﹣+N2↑+6H2O|Fe﹣2e﹣=Fe2+|12
【解析】解:(1)由化合价代数和为0可知CrO42﹣中Cr元素的化合价为+6价,所以答案是:+6;(2)亚硫酸钠具有还原性,与CrO42﹣发生氧化还原反应生成Cr3+和硫酸钠,反应的离子方程式为2CrO42﹣+3SO32﹣+10H+=2Cr3++3SO42﹣+5H2O,
所以答案是:2CrO42﹣+3SO32﹣+10H+=2Cr3++3SO42﹣+5H2O;(3)碱性条件下,NaClO将CN﹣氧化为碳酸根和氮气,碱性条件下生成生成碳酸根离子,反应方程式为:5ClO﹣+2CN﹣+2OH﹣=2CO32﹣+N2↑+5Cl﹣+H2O,若pH<8.5,则生成剧毒的CNCl气体,反应的离子方程式为CN﹣+ClO﹣+H2O=CNCl+2OH﹣,
所以答案是:N2、CO32;CN﹣+ClO﹣+H2O=CNCl+2OH﹣;(4)反应Ⅰ、Ⅱ、分别为酸性、碱性,混合可发生中和反应,且分别含有还原性、氧化性物质,可发生氧化还原反应,经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合,可使两个反应中过量的氧化剂和还原剂反应,以及发生中和反应,
所以答案是:使两个反应中过量的氧化剂和还原剂反应,以及发生中和反应;(5)①氰离子在碱性条件下被氧化为无毒的物质,应被氧化生成氮气,为阳极反应,电极方程式为2 CN﹣+12OH﹣﹣10e﹣=2 CO32﹣+N2↑+6H2O,
所以答案是:2 CN﹣+12OH﹣﹣10e﹣=2 CO32﹣+N2↑+6H2O;②铁为阳极,可被氧化生成亚铁离子,电极方程式为Fe﹣2e﹣=Fe2+,反应的关系式为6Fe~12e﹣~6Fe2+~Cr2O72﹣,当有1mol Cr2O72﹣被还原时,有12mol电子转移,
所以答案是:Fe﹣2e﹣=Fe2+;12.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案