��Ŀ����
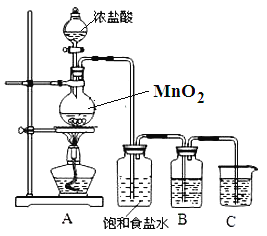
����Ŀ����ͼ��ʾΪʵ�����г����������Ʊ����������ռ�������ʵ��IJ�������(��װʵ��װ��ʱ�����ظ�ѡ������)��
�Ը�����ĿҪ�ش��������⣺
��1���������ۺ�ϡ����(������лӷ���)��Ӧ��ȡ���ռ������������
����ȡ���ռ������������ѡ����������˳��Ϊ (��д���������ĸ)��
������ʵ��ǰ������Ҫ����һ�������� ��
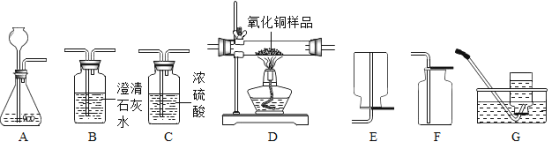
��2��С��ͬѧ����һ����̼����(������������̼��ˮ����)�ⶨ10�˲�������ͭ��Ʒ�Ĵ���(���ʲ����뷴Ӧ)������֤��Ӧ����������������ʡ���ѡ����������˳��Ϊ��B1��C��D��B2��
��д��װ��B1�з�����Ӧ�Ļ�ѧ����ʽ ��
��װ��D�й۲쵽��ʵ�������� ��
������ʵ��������B2װ�õ������ȷ�Ӧǰ������4.4�ˣ��ɴ������װ��D�й�������������� �ˡ�
��С��ͬѧ����Ʒ�����һ���ԵIJ��㣬��������������ɵĺ���� ��
���𰸡���1����ABCE�������װ�õ������ԣ�
��2����Ca(OH)2+CO2=CaCO3��+H2O������ɫ�����Ϊ��ɫ���壻
��1.6g����δ��Ӧ��CO����Ⱦ������
��������
�����������1���������ۺ�ϡ����(������лӷ���)��Ӧ��ȡ������Aװ�ã�����ӷ��Ȼ������壬���е��Ȼ��������ó����ʯ��ˮ��ȥ��������Ũ���ᣬ�����ܶȱȿ���С���������ſ������ռ������������Һ�г��������ˮ����������Ҫ�ȳ����ٸ��Ȼ���ռ�������ȡ���ռ������������ѡ����������˳��ΪABCE���ʴ�Ϊ��ABCE����ʵ��ǰҪ���װ�õ������ԣ���ֹװ��©�����ʴ�Ϊ�����װ�õ������ԣ�
��2����װ��B1�з�����Ӧ�Ƕ�����̼�����ʯ��ˮ�ķ�Ӧ�����߷�Ӧ����̼��Ƴ�����ˮ������ʽ��Ca(OH)2+CO2�TCaCO3��+H2O���ʴ�Ϊ��Ca(OH)2+CO2�TCaCO3��+H2O��
��һ����̼���л�ԭ�ԣ��ɽ���ɫ������ͭ��ԭΪ��ɫ��ͭ���ʴ�Ϊ����ɫ�����Ϊ��ɫ���壻
��������������֪��װ��D�й�����ٵ�����������ͭ����Ԫ�ص�������B2װ�÷ŵ��dz����ʯ��ˮ������һ����̼������ͭ��Ӧ���ɵĶ�����̼��ַ�Ӧ���ʸ�װ�����ӵ��������Ƿ�Ӧ���ɵĶ�����̼������������Ʒ������ͭ������Ϊx
CuO+CO![]() Cu+CO2
Cu+CO2
80 44
x 4.4g
![]() =
=![]() ��x=8g������ͭ����Ԫ�ص�����Ϊ��8g��
��x=8g������ͭ����Ԫ�ص�����Ϊ��8g��![]() ��100%=1.6g����װ��D�й�����ٵ�������1.6g���ʴ�Ϊ��1.6��
��100%=1.6g����װ��D�й�����ٵ�������1.6g���ʴ�Ϊ��1.6��
��С��δ���β������װ�ã���ʹδ�μӷ�Ӧ��һ����̼�ŷŵ���������Ⱦ�������ʴ�Ϊ��δ��Ӧ��CO����Ⱦ������

����Ŀ��������ͼ�ķ�Ӧ��
x�� | y�� | ||
A | ���Ȼ�����Һ�м�������������Һ | �������Ƶ����ʵ��� | ���ɳ��������� |
B | ��̼������Һ�м���ϡ���� | �������� | ������������ |
C | ���廯������Һ��ͨ������ | ��������� | ����Br2�����ʵ��� |
D | ������������Һ��ͨ�������̼ | ������̼����� | ����̼����Ƶ����� |