题目内容
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
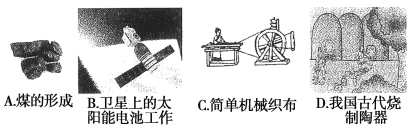
(1)下列生产、生活中的事例中没有发生氧化还原反应的是( )
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
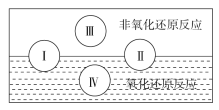
试写出有水参加的符合反应类型Ⅳ的一个离子反应方程式: ,其中水为________剂。
(3)氯化铵常用于焊接。如在焊接铜器时用过量的浓氯化铵溶液除去铜器表面的氧化铜以便焊接,其反应为:____CuO+____NH4Cl![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。(配平时系数为“1”必须写出)
②该反应中,被氧化的元素是________(填元素名称),氧化剂是____________(填化学式)。
③往反应后的热溶液中加入过量澄清的石灰水,发现有气泡产生和蓝色沉淀生成,写出两个相应现象的离子方程式: 。
【答案】(1)C
(2)2Na+2H2O===2Na++OH-+H2↑,水做氧化剂。
(3)①4CuO+2NH4Cl![]() 3Cu+ 1 CuCl2+ 1 N2↑+4H2O ②氮 CuO
3Cu+ 1 CuCl2+ 1 N2↑+4H2O ②氮 CuO
③NH4++OH-![]() NH3↑+H2O Cu2++2OH-=Cu(OH)2↓
NH3↑+H2O Cu2++2OH-=Cu(OH)2↓
【解析】
试题分析:(1)煤的形成过程、卫星上太阳能电池的工作过程及我国古代烧制陶器的过程中都涉及有氧化还原反应,而简单的机械织布过程中无氧化还原反应,故答案C;(2)由“四种基本反应类型与氧化还原反应关系图”可知,I为化合反应(或分解反应),Ⅱ为分解反应(或化合反应),Ⅲ为复分解反应,Ⅳ为置换反应;有水参加的置换反应有很多,比如Na与水的反应,离子方程式为:2Na+2H2O===2Na++OH-+H2↑,在该反应中,水作氧化剂;(3)①利用氧化还原反应的得失电子守恒,并结合原子守恒、电荷守恒可配平化学方程式:4CuO+2NH4Cl![]() 3Cu+ 1 CuCl2+ 1 N2↑+4H2O;②在该反应中,铜元素化合价降低,被还原,CuO作氧化剂,Cu是还原产物;氮元素化合价升高,被氧化,NH4Cl作还原剂,N2是氧化产物;因此被氧化的元素是氮元素,氧化剂是CuO;③往反应后的热溶液中加入过量澄清的石灰水,发现有气泡产生和蓝色沉淀生成,证明生成了NH3和Cu(OH)2沉淀,化学方程式分别为:NH4++OH-
3Cu+ 1 CuCl2+ 1 N2↑+4H2O;②在该反应中,铜元素化合价降低,被还原,CuO作氧化剂,Cu是还原产物;氮元素化合价升高,被氧化,NH4Cl作还原剂,N2是氧化产物;因此被氧化的元素是氮元素,氧化剂是CuO;③往反应后的热溶液中加入过量澄清的石灰水,发现有气泡产生和蓝色沉淀生成,证明生成了NH3和Cu(OH)2沉淀,化学方程式分别为:NH4++OH-![]() NH3↑+H2O,Cu2++2OH-=Cu(OH)2↓。
NH3↑+H2O,Cu2++2OH-=Cu(OH)2↓。