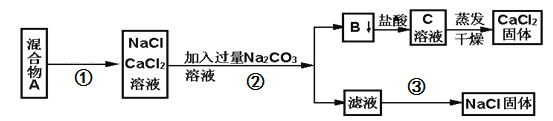
题目内容
【题目】Ⅰ、Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式:_____________________。
Ⅱ、某学生课外活动小组模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
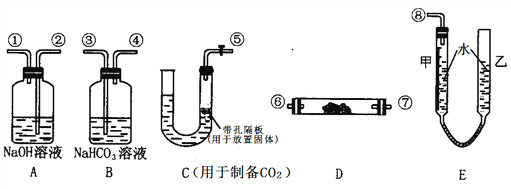
请回答下列问题:
(1)图中各装置接口连接顺序是_____________________(填各接口的编号,其中连接胶管及夹持装置均省略,):
→ → → ⑥ → ⑦ → → →
(2)装置D中发生反应的化学方程式为:_______________。
(3)装置B的作用是(用离子方程式表示):_______________。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,还应注意_______(填字母编号)。
a.视线与液体凹液面最低处相平才读数
b.等待气体恢复常温才读数
c.上下移动乙管,使甲乙两管液面相平才读数
(5)实验测得收集的氧气在标准状况下体积为V L,则参与反应的Na2O2 的物质的量为________mol。
【答案】2SO3+2Na2O2=2Na2SO4+O2⑤③④,②①⑧2Na2O2 + 2CO2 = 2Na2CO3 + O2 2Na2O2 + 2H2O = 4NaOH + O2↑HCO3- + H+ = H2O + CO2↑abcV/11.2
【解析】试题分析:Ⅰ、根据过氧化钠和CO2的反应原理类比书写过氧化钠和SO3的反应;
Ⅱ、题目要求利用过氧化钠与二氧化碳(潮湿)反应制取氧气,故首先需要制备二氧化碳。只有仪器C可以用来制取二氧化碳。制气原料应该采用大理石和盐酸,此法制得的二氧化碳中会含有少量氯化氢。须通过装有碳酸氢钠溶液的洗气瓶,以除去这些氯化氢。然后使净化后的二氧化碳通过过氧化钠来制取氧气,该仪器只能选用装置D。此反应属于气体与固体之间的反应,不易反应完全,为了除去生成的氧气中混有未反应的二氧化碳,可以使它们通过仪器A。在测量氧气体积时,为了使测量更为准确,要注意上下移动仪器E中的乙管,使甲、乙两管的液面相平,以使甲管中的气压与大气气压相等,同时视线应与甲管内凹液面最低处相平,以减少观察误差。最后根据方程式计算过氧化钠的物质的量。
解析:Ⅰ、Na2O2与CO2(g)反应生成碳酸钠和氧气,则Na2O2与SO3反应的化学方程式为2SO3+2Na2O2=2Na2SO4+O2↑;
Ⅱ、(1)仪器C可以用来制取二氧化碳,连接③用来除去HCl,④连接⑥可使二氧化碳与过氧化钠反应生成氧气,然后连接②可除去未反应的二氧化碳,最后连接⑧测量气体的体积,所以顺序为⑤③④⑥⑦②①⑧;
(2)装置D中过氧化钠与CO2及水蒸气发生反应的化学方程式分别为2Na2O2 + 2CO2=2Na2CO3 + O2、2Na2O2 + 2H2O=4NaOH + O2↑;
(3)仪器C可以用来制取二氧化碳,此法制得的二氧化碳中会含有少量氯化氢,须通过装有碳酸氢钠溶液的洗气瓶,以除去这些氯化氢,反应的离子方程式为HCO3- + H+ = H2O + CO2↑;
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数。求其差值的过程中,应注意:①等待气体恢复常温才读数;②读数时要调节E中甲乙的液面使其同一高度;③读数时视线要与凹液面最低处相平;
(5)2Na2O2 + 2CO2=2Na2CO3 + O2
2mol 22.4L
n VL
n=2mol×VL/22.4L=V/11.2mol。

【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。回答下列问题:
3Na2S2O3+CO2。回答下列问题:

(1)装置A的作用是制备______________,反应的化学方程式为______________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出, ② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2 2Na2S+3SO2 Na2SO3+S |
当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,______________。