题目内容
(5分)化学实验中,常用沉淀法对溶液中的阳离子处理成沉淀进行分离。某溶液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用OH-、CO32-、Cl-三种不同阴离子使上述金属阳离子逐一形成沉淀。
(1)加入阴离子的顺序是:
(2)按顺序写出相关的离子方程式 :
:
(1)加入阴离子的顺序是:
(2)按顺序写出相关的离子方程式
 :
: 
略

练习册系列答案
相关题目
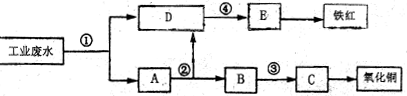
 明;
明; _离子
_离子 小试管各
小试管各