题目内容
【题目】(l)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是________,B原子的杂化轨道类型是_____________。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/ kJ·mol-1 | I2/ kJ·mol-1 | I3/ kJ·mol-1 | I4/ kJ·mol-1 | I5/ kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____ (填元素符号),判断理由为________________________。
(2)铜晶体中铜原子的堆积方式如图24所示,铜晶体中原子的堆积模型属于______。

(3)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图25所示(黑点代表铜原子)。
①该晶体的化学式为______________________。
②该化合物难溶于水但易溶于氨水,其原因是_______________________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______________________。
③已知该晶体的密度为pg . cm-3,阿伏伽德罗常数为NA,已知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为______pm。
【答案】 1 正四面体 sp3 Mg 第3电离能比第2电离能大很多,说明最外层有2个电子 面心立方密堆积 CuCl Cu+可与氨形成易溶于水的配位化合物(或配离子) [Cu(NH3)4]2+  ×1010
×1010
【解析】(l)①Ti的基态原子核外电子排布式为:1s22s22p63s22p63d24s2,则Ti3+的电子排布式为:1s22s22p63s22p63d1,未成对电子数有1个,故答案为:1;
②BH4-中B原子价层电子数=4+![]() (3+14×1)=4,且不含孤电子对,采用sp3杂化,故答案为:正四面体;sp3;
(3+14×1)=4,且不含孤电子对,采用sp3杂化,故答案为:正四面体;sp3;
③该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素,故答案为:Mg;第3电离能比第2电离能大很多,说明最外层有2个电子;
(2)根据铜晶体中铜原子的堆积方式可知,铜晶体中原子的堆积模型属于面心立方密堆积,故答案为:面心立方密堆积;
(3) ①某M原子的外围电子排布式为3S23p5,则M为Cl;根据均摊法,晶胞中Cu原子数目为4、Cl原子数目为8×![]() +6×
+6×![]() =4,则化学式为CuCl,故答案为:CuCl;
=4,则化学式为CuCl,故答案为:CuCl;
②Cu+可与氨形成易溶于水的配位化合物(或配离子),使得该化合物难溶于水但易溶于氨水;此化合物的氨水溶液遇到空气则被氧化为深蓝色的四氨合铜离子,化学式为[Cu(NH3)4]2+,故答案为:Cu+可与氨形成易溶于水的配位化合物(或配离子);[Cu(NH3)4]2+;
③Cu原子与周围的4个Cl原子形成正四面体结构,四面体中心Cu原子与顶点氯原子距离最近,四面体中心的Cu原子与晶胞顶点Cl原子连线处于晶胞体对角线上,且距离为体对角线长度的![]() ,而体对角线长度为晶胞棱长的
,而体对角线长度为晶胞棱长的![]() 倍,晶胞质量为4×
倍,晶胞质量为4×![]() g,设晶胞棱长为a cm,则4×
g,设晶胞棱长为a cm,则4×![]() g=pgcm-3×(a cm)3,解得a=
g=pgcm-3×(a cm)3,解得a= cm,则该晶体中铜元子与M原子之间的最短距离为
cm,则该晶体中铜元子与M原子之间的最短距离为![]() ×
×![]() ×
×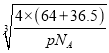 cm=
cm=![]() ×
×![]() ×
× ×1010pm,故答案为:
×1010pm,故答案为: ![]() ×
×![]() ×
× ×1010。
×1010。

【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
【题目】(1)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH=+19 kJ·mol-1 ③
请写出CO还原FeO的热化学方程式:_______________________。
(2)某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
①T ℃时,该反应的平衡常数K=________。
②30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A
c.适当缩小容器的体积 d.升高反应体系温度
③若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。