题目内容
【题目】已知某些化学键的键能数据如下:

(1)通过比较C—C 和 C=C 的键能大小,简要说明为什么烯烃易发生加成反应而烷烃不能?______ 。
(2)利用键能数据可判断反应 2H2 + O2 → 2 H2O 为 放热反应, 计算每生成 1 mol H2O 所放出的热量为_____________ kJ。
(3)若某有机物的结构简式如下: ![]() ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:________________
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:________________
(4)将硫酸铜白色固体溶于水得到蓝色的溶液,原因是生成了一种配合离子,其结构简式为: ___________(标明配位键),向该溶液中加入过量稀氨水得深蓝色溶液,其离子方程式为 _________ 。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是_________________________________。
【答案】C=C的健能<2C-C,说明π健易断裂,而δ健不易断裂 241 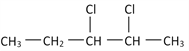
 [Cu(H2O)4]2++4NH3=[Cu(NH3)4]2++4H2O NF3分子中氟原子电负性强,吸电子,使氮原子上的孤对电子难于与Cu2+形成配位键
[Cu(H2O)4]2++4NH3=[Cu(NH3)4]2++4H2O NF3分子中氟原子电负性强,吸电子,使氮原子上的孤对电子难于与Cu2+形成配位键
【解析】
(1)根据化学键的键能数据可知,C=C的键能<2C-C,说明π键易断裂,而δ键不易断裂故烯烃易发生加成反应而烷烃不能;
(2)反应热=反应物总键能-生成物总键能,则反应 2H2 + O2 =2H2O △H=2mol×436kJ/mol+1mol×498kJ/mol-4mol×463kJ/mol =-482kJ/mol,每生成 1 mol H2O 所放出的热量为241kJ;
(3)若某有机物的结构简式如下: ![]() ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,分别为2,3-二氯戊烷和3,3-二氯戊烷,其中属于手性分子的物质为2,3-二氯戊烷,其结构简式为:
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,分别为2,3-二氯戊烷和3,3-二氯戊烷,其中属于手性分子的物质为2,3-二氯戊烷,其结构简式为: ;
;
(4)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,其结构简式为: ;生成此配合离子的离子方程式为:[Cu(H2O)4]2++4NH3=[Cu(NH3)4]2++4H2O;NF3分子中氟原子电负性强,吸引孤对电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键。
;生成此配合离子的离子方程式为:[Cu(H2O)4]2++4NH3=[Cu(NH3)4]2++4H2O;NF3分子中氟原子电负性强,吸引孤对电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键。