题目内容
等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,其中
- A.Na2CO3放出的CO2多
- B.NaHCO3放出的CO2多
- C.Na2CO3放出CO2的速度快
- D.NaHCO3放出CO2的速度快
D
正确答案:D
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
由方程式可知,等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,产生的CO2一样多,1molNaHCO3只需1molHCl,所以放出CO2的速度快。故D正确。
正确答案:D
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
由方程式可知,等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,产生的CO2一样多,1molNaHCO3只需1molHCl,所以放出CO2的速度快。故D正确。

练习册系列答案
相关题目
下述实验操作与预期实验目的或所得实验结论不一致的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗涤液中加稀盐酸,有气泡产生 | 说明常温下,Ksp(BaCO3)< Ksp(BaSO4) |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度,平衡移动的方向 |
| C | 将SO2通入品红溶液,褪色后加热,观察颜色能否恢复 | 验证SO2漂白的可逆性 |
| D | 分别测同温同物质的量浓度Na2CO3和Na2SO4水溶液的pH | 探究碳和硅两元素非金属性强弱 |
 是一种会产生温室效应的气体,等物质够量的
是一种会产生温室效应的气体,等物质够量的 产生的温室效应,前者大,下面有关天然气的几种叙述中正确的是
产生的温室效应,前者大,下面有关天然气的几种叙述中正确的是 是一种会产生温室效应的气体,等物质够量的
是一种会产生温室效应的气体,等物质够量的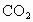 产生的温室效应,前者大,下面有关天然气的几种叙述中正确的是
产生的温室效应,前者大,下面有关天然气的几种叙述中正确的是