题目内容
【题目】硫酰氯(SO2Cl2)熔点-54.1℃,沸点在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。

(1)SO2Cl2中的S的化合价为_______________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为_______________。
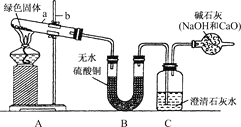
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(部分夹持装置未画出)。
①仪器A的名称为_______________,装置乙中装入的试剂是_______________,装罝B的作用是_______________。
②装置丙分液漏斗中盛装的最佳试剂是_______________(选填编号)。
A.蒸馏水 B.l0.0mol·L-1浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL0.50000mol·L-1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L-1标准HC1滴定至终点,重复实验三次取平均值,消耗HCl l0.00mL。达到滴定终点的现象为_______________,产品的纯度为_______________。
【答案】+6 SO2Cl2+2H2O=2HCl↑+H2SO4 冷凝管 浓硫酸 防止空气中水蒸汽进入三颈烧瓶,使SO2Cl2发生水解变质并能吸收尾气SO2和Cl2,防止污染环境 D 滴加最后一滴HCl标准液,锥形瓶中溶液由黄色变为橙色,且半分钟不恢复 75%
【解析】
(1)SO2Cl2中,O的化合价是-2价,Cl的化合价是-1价,计算可得S的化合价是+6价。SO2Cl2中与水发生反应“发烟”的化学方程式为:SO2Cl2+2H2O=2HCl↑+H2SO4。
(2)①如上图,甲是反应的发生装置,仪器A是球形冷凝管,作用是冷凝回流SO2C12;B是球形干燥管,装有碱石灰,其作用是防止空气中水蒸气的进入,还可以吸收尾气SO2和C12,防止污染环境;丙是提供氯气的装置,乙的作用是除去氯气中的杂质。由于通入甲的氯气必须是干燥的,故乙中应加入干燥剂,图中所示为液体干燥剂,即浓硫酸。故答案为:冷凝管;浓硫酸;防止空气中水蒸汽进入三颈烧瓶,使SO2C12发生水解变质并能吸收尾气SO2和C12,防止污染环境。
②利用加入的液体使集气瓶中的氯气排出,氯气在饱和食盐水中溶解度小,因此选D。
③硫酰氯在水溶液中与水反应生成盐酸和硫酸,都是酸性物质,与氢氧化钠可以发生反应。因此在过量的NaOH溶液中加热充分水解,得到Na2SO4、NaCl和NaOH的混合溶液。滴加甲基橙后,由于溶液显碱性,因此显黄色。用0.1000mol·L-1标准HC1滴定至终点时,观察到的现象为锥形瓶中溶液由黄色变为橙色,且半分钟不恢复。消耗的HCl的物质的量与滴定所取25mL混合溶液中NaOH的物质的量相等,为0.1000mol·L-1×0.0100L=0.001mol,由于滴定所取的溶液为原混合溶液的1/10,故原混合溶液中含有NaOH 0.01mol。与氯化氢和硫酸反应消耗的NaOH为0.100L×0.50000mol·L-1-0.010mol=0.04mol,根据总反应方程式SO2C12+4NaOH=2NaC1+Na2SO4+2H2O可知,原产品中含有SO2C12的物质的量为0.01mol,质量为0.01mol×135g/mol=1.35g,产率为1.35g÷1.800g×100%=75%。故答案为:滴加最后一滴HC1标准液,锥形瓶中溶液由黄色变为橙色,且半分钟不恢复;75%。

【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
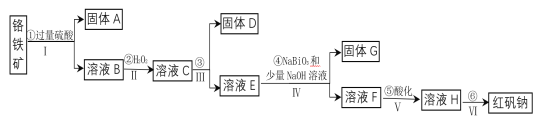
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42—,自身被还原为Bi(OH)3固体。
ii.
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
开始沉淀的PH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的PH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是___________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式________________。
(4)⑤中酸化是使CrO42—转化为Cr2O72—。写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
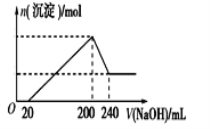
(6)取一定质量的固体D溶解于200mL的稀硫酸中,向所得溶液中加入5.0mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。