题目内容
100℃时,Kw=10-12,将100℃时pH=10的NaOH溶液和pH=1的H2SO4混合,所得混合溶液的pH=2,则NaOH溶液和H2SO4溶液的体积比是
| A.11 : 1 | B.12 : 11 | C.9 : 2 | D.9: 1 |
C
试题分析:Kw=10-12,NaOH溶液中氢氧根则为10-2 mol/L,氢氧化钠中氢氧根的物质的量浓度为0.01mol/L,硫酸中氢离子的物质的量浓度为0.1mol/L。
设氢氧化钠体积为X,硫酸体积为Y。
(0.1Y-0.01X)÷(X+Y)=0.01
化简得:X:Y=9:2,故选C。
点评:对于酸碱混合的计算,首先要判断混合液的酸碱性。属于较简单题。

练习册系列答案
相关题目
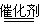 2CO2+N2
2CO2+N2 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果 实验数据
实验数据
 )
)