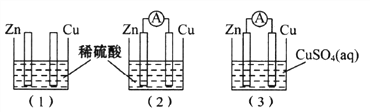
题目内容
【题目】25℃,水的电离平衡:H2O![]() H++OH-ΔH>0,下列叙述正确的是
H++OH-ΔH>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,c(H+)不变,pH不变
【答案】B
【解析】试题分析:A.向水中加入氨水,溶液中氢氧根离子浓度增大,抑制水的电离,平衡向逆反应方向移动,氨水中的氢氧根离子远远大于水减少的氢氧根离子,所以溶液中氢氧根离子浓度增大,故A错误;B.向水中加入硫酸氢钠固体,硫酸氢钠电离出氢离子,导致溶液中氢离子浓度增大,因为温度不变,则KW不变,故B正确;C.向水中加入少量固体CH3COONa,醋酸根离子和氢离子反应生成弱电解质,导致c(H+)降低,平衡正向移动,故C错误;D.水的电离是吸热反应,升高温度,促进水电离,KW增大,pH变小,故D错误;故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,.则表中X离子种类及其个数b为
离子种类 | Na+ | Al3+ | Cl- | X |
个数 | 2a | a | a | b |
A. NH4+、4a B. SO42-、2a C. OH-、4a D. CO32-、2a
【题目】下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是 。
A.H2 B.Cl2C.Br2D.I2
(2)X2+H2![]() 2HX (X代表Cl、Br、I)的反应是放热反应还是吸热反应?
2HX (X代表Cl、Br、I)的反应是放热反应还是吸热反应?
(3)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
(4)若无上表中的数据,你能回答问题(3)吗? (回答“能”或“不能”)。你的依据是 。