题目内容
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。如图是过氧化氢法生产亚氯酸钠的工艺流程图:
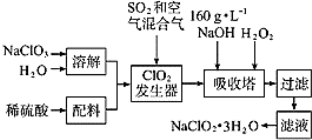
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是 (选序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3氧化成ClO2
(2)发生器中产生ClO2的离子反应方程式为 。
(3)吸收塔内反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2 外,还可以选择的还原剂是 (选序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是 (选序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
【答案】(1)b;(2)2ClO3-+SO2=2ClO2+SO42-;
(3)2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
防止H2O2受热分解,有利于NaClO23H2O的析出;
(4)连续测定吸收塔内溶液的pH;(5)a;(6)bed。
【解析】
试题分析:(1)根据信息②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,因此通入空气的目的,稀释ClO2,故选项b正确;(2)根据流程图,通入的物质有NaClO3、SO2,生成ClO2,可见Cl的化合价降低,S的化合价升高,ClO3-化合价由+5价→+4价,SO2中S的化合价由+4价→+6价,最小公倍数为2,即ClO3-和Cl-的系数为2,因此离子反应方程式为:2ClO3- + SO2 = 2ClO2 + SO42- ;(3)吸收塔中生成NaClO2,ClO2中Cl的化合价由+4价→+3价,化合价降低1价,H2O2中O的化合价升高,生成O2,化合价共升高2价,最小公倍数为2,因此化学反应方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;过氧化氢不稳定,受热易分解,同时使NaClO2·3H2O析出;(4)连续测定吸收塔内溶液的pH;(5)为了不引入新杂质,因此用Na2O2,用Na2S和FeCl2,引入S和Fe3+,故选项a正确;(6)采用蒸发浓缩,冷却结晶、过滤的方法,即顺序是bed。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案