题目内容
1.铁是人类目前使用最多的金属,可以形成多种氧化物.某实验小组欲利用氢气还原法测定某铁的氧化物(FexOy)的组成,根据实验内容回答下列问题:
I.定性分析:氧化物中铁元素的价态
(1)取适量该氧化物溶于过量的稀硫酸(填“稀硫酸”、“稀盐酸”或“稀硝酸”),取少量溶液分别装入两支洁净的试管甲、乙中.甲试管中加入高锰酸钾溶液,乙试管中加入硫氰化钾溶液,能证明该氧化物中同时含有Fe2+、Fe3+的现象是:甲试管中溶液紫色变浅或褪去,乙试管中溶液变红.
II.定量分析:氧化物的组成
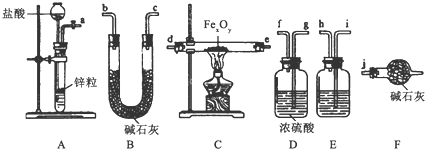
(2)按各部分仪器在该实验中的作用分析:装置E中盛放的药品是蒸馏水(或NaOH溶液),作用是除去H2中混有的HCl.
(3)实验装置用上面所列仪器组成,按氢气流向的连接顺序是(括号中填入接口字母):
a→i→h→g→f→d→e→b→c→j
(4)实验前,将该铁的氧化物放在坩埚内低温烘焙,这样做的目的是:除去样品中的水蒸气,防止U形管产生额外的增重,若缺少此步骤,会导致x:y偏小(填“偏大”、“偏小”或“无影响”).
(5)称取烘焙后样品3.04g,与氢气充分反应后生成水0.9g,则该样品的组成为:Fe4O5(或2FeO•Fe2O3).
分析 I.定性分析:氧化物中铁元素的价态
(1)证明该氧化物中同时含有Fe2+、Fe3+,加入的试剂若加入盐酸,溶液中的氯离子被高锰酸钾溶液氧化,干扰亚铁离子的检验,硝酸具有强氧化性能氧化亚铁离子,甲试管中加入高锰酸钾溶液,乙试管中加入硫氰化钾液,证明含有亚铁离子的现象是甲中褪色,证明含有铁离子的现象是乙中变红色;
II.定量分析:氧化物的组成
(2)分析装置图可知,A装置制备氢气,含有水蒸气和氯化氢杂质,需要通过装置E中的水或氢氧化钠溶液除去氯化氢气体,再通过浓硫酸吸收氢气中的水蒸气,得到干燥纯净的氢气通入装置C中分手氧化还原反应;
(3)分析装置图可知,A装置制备氢气,含有水蒸气和氯化氢杂质,需要通过装置E中的水或氢氧化钠溶液除去氯化氢气体,再通过浓硫酸吸收氢气中的水蒸气,得到干燥纯净的氢气通入装置C中分手氧化还原反应,生成水和铁,水蒸气用装置B吸收称重,最后为避免空气中的水蒸气和二氧化碳进入装置B影响测定结果,连接装置F;
(4)实验前,将该铁的氧化物放在坩埚内低温烘焙除去固体中的水分,减少实验的测定结果影响,若缺少此步骤,测定水的质量增大,氢气量增大,计算得到氧元素质量增大,x:y比值减小;
(5)依据生成水的质量计算物质的量,结合元素守恒得到氧元素质量和铁元素质量,计算得到x:y,写出化学式.
解答 解:I.定性分析:氧化物中铁元素的价态
(1)证明该氧化物中同时含有Fe2+、Fe3+,加入的试剂若加入盐酸,溶液中的氯离子被高锰酸钾溶液氧化,干扰亚铁离子的检验,硝酸具有强氧化性能氧化亚铁离子,所以只有选择硫酸,取少量溶液分别装入两支洁净的试管甲、乙中.甲试管中加入高锰酸钾溶液,乙试管中加入硫氰化钾溶液,能证明该氧化物中同时含有Fe2+、Fe3+的现象是,证明含有亚铁离子的现象是甲中褪色,证明含有铁离子的现象是乙中变红色,
故答案为:稀硫酸;甲试管中溶液紫色变浅或褪去,乙试管中溶液变红;
II.定量分析:氧化物的组成
(2)由装置图可知,A装置制备氢气,含有水蒸气和氯化氢杂质,需要通过装置E中的水或氢氧化钠溶液除去氯化氢气体,再通过浓硫酸吸收氢气中的水蒸气,得到干燥纯净的氢气通入装置C中发生氧化还原反应,
故答案为:蒸馏水(或NaOH溶液);除去H2中混有的HCl;
(3)分析装置图可知,A装置制备氢气,含有水蒸气和氯化氢杂质,需要通过装置E中的水或氢氧化钠溶液除去氯化氢气体,再通过浓硫酸吸收氢气中的水蒸气,得到干燥纯净的氢气通入装置C中发生氧化还原反应,生成水和铁,水蒸气用装置B吸收称重,最后为避免空气中的水蒸气和二氧化碳进入装置B影响测定结果,连接装置F,实验装置用上面所列仪器组成,按氢气流向的连接顺序是aihgfdebcj,
故答案为:ihgfdebcj;
(4)实验前,将该铁的氧化物放在坩埚内低温烘焙除去固体中的水分,减少实验的测定结果影响,若缺少此步骤,测定水的质量增大,氢气量增大,计算得到氧元素质量增大,x:y比值减小;
故答案为:故除去样品中的水蒸气,防止U形管产生额外的增重;偏小;
(5)称取烘焙后样品3.04g,与氢气充分反应后生成水0.9g,n(H2O)=$\frac{0.9g}{18g/mol}$=0.05mol,氧元素质量=0.05mol×16g/mol=0.8g,铁元素物质的量n(Fe)=$\frac{3.04g-0.8g}{56g/mol}$=0.04mol,n(Fe)=n(O)=0.04:0.05=4:5,则该样品的组成为Fe4O5(或2FeO•Fe2O3),
故答案为:Fe4O5(或2FeO•Fe2O3).
点评 本题考查了物质组成的实验探究方法和实验设计应用,主要是试剂作用的理解分析,物质性质和实验基本操作是解题的关键,题目难度中等.

| A. | 原电池中电解质溶液能电离出自由移动的离子 | |
| B. | 有两根导线将两个活动性不同的电极连接 | |
| C. | 电极上进行的氧化还原反应的生成物为电子 | |
| D. | 电极上进行氧化还原反应时有电子的定向移动 |
| A. | CO、NO能与人体的血红蛋白结合,使人中毒 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 光化学烟雾会引起呼吸道疾病 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烯的分子式:C2H4 | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | 丙烷分子的球棍模型是 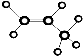 |
| A. | 浓盐酸 | B. | 浓硫酸 | C. | 食盐 | D. | 氢氧化钠 |
| 实验 | 电极甲 | 电极乙 |
| I | Zn | Cu |
| Ⅱ | Al | Cu |
| A. | 两组实验溶液的pH均增大 | |
| B. | 实验Ⅱ中,H+向Al定向迁移 | |
| C. | 实验I中,甲电极反应为:2H++e-=H2↑ | |
| D. | 实验Ⅱ中,电子由铜转移到锌 |
 .从分液漏斗上口倒出的上层液体是苯.
.从分液漏斗上口倒出的上层液体是苯.
 .
. .
. ②
② 中氯原子较难水解物质A(
中氯原子较难水解物质A( )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 +2Cl2
+2Cl2
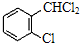 +2HCl、
+2HCl、 +2NaOH
+2NaOH
 +2NaCl+2H2O.
+2NaCl+2H2O. 和
和 .
. ,两个取代基分别在间位和对位,共3种
,两个取代基分别在间位和对位,共3种
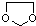 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$