题目内容
13.松油醇是一种天然有机化合物,其结构如图所示.下列有关松油醇的叙述正确的是( )
| A. | 松油醇的分子式为C10H16O | |
| B. | 1 mol松油醇与足量金属钠反应可生成标准状况下的H2 22.4L | |
| C. | 可以用酸性高锰酸钾溶液鉴别苯乙烯和松油醇 | |
| D. | 松油醇能发生加成反应、氧化反应、酯化等反应 |
分析 由结构简式可知,该物质的分子式为C10H18O,含C=C及-OH,结合烯烃和醇的性质来解答.
解答 解:A.松油醇的分子式为C10H18O,故A错误;
B.只含有1个羟基,则1 mol松油醇与足量金属钠反应可生成标准状况下的H2 11.2L,故B错误;
C.含有碳碳双键,可被酸性高锰酸钾氧化,不能鉴别,故C错误;
D.含C=C,能发生加成、氧化反应,含-OH,能酯化反应,故D正确,
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,注意把握官能团和性质的关系,熟悉醇、烯烃的性质即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.用NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 14gC2H4和C4H8NA的混合气体中所含的共价键数为3NA | |
| B. | 化学反应中每生成1molO2转移电子数为4NA | |
| C. | 12g413C含有的碳原子数是NA | |
| D. | 0.1molNa2O2所含阴离子数是0.2NA |
1.下列说法正确的是( )
| A. | 分子式为C10H12O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 | |
| B. | 对苯二甲酸( 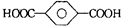 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( 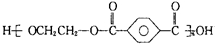 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 | |
| D. | 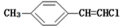 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
8. 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )| A. | b是阳离子交换膜,允许Na+通过 | B. | 从A口出来的是NaOH溶液 | ||
| C. | 阴极反应式为4OH--4e-═2H2O+O2↑ | D. | Na2SO4溶液从G口加入 |
18.邻苯二甲酸二乙酯是增塑剂,其结构简式如图,关于该物质的说法中正确的是( )
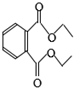

| A. | 该物质能使溴的四氯化碳溶液褪色 | |
| B. | 其分子式为C12H15O4 | |
| C. | 该物质完全水解能生成三种产物 | |
| D. | 1mol该物质与足量NaOH溶液反应能消耗2molNaOH |
5.化学与生活、生产密切相关.下列叙述正确的是( )
| A. | 硅胶和铁粉常用于食品包装袋中作抗氧化剂,它们都是无机物 | |
| B. | 食盐和食醋常用于厨房中作调味品,它们都是盐 | |
| C. | 硅和石英常用于制作光导纤维,它们都是原子晶体 | |
| D. | 氢氧化铝和碳酸氢钠常用于消除胃酸过多,它们都是电解质 |
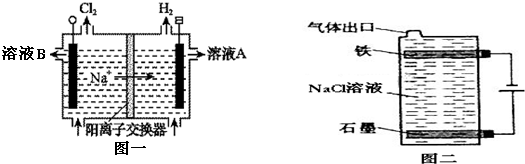
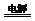 NaClO+H2↑.电解结束后一段时间,有同学发现铁电极表面变成红褐色,则反应方程式为3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.
NaClO+H2↑.电解结束后一段时间,有同学发现铁电极表面变成红褐色,则反应方程式为3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.