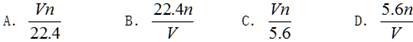题目内容
(1)将2.0 mol/L CuSO4溶液和1.0 mol/L H2SO4溶液等体积混合(假设混合前后溶液体积不发生变化),所得混合液中C(CuSO4)= mol/L,C(SO42-)= mol/L。
(2)往100 mL 2 mol/L 的AlCl3溶液中逐滴加入 NaOH 溶液 100 mL 时,产生沉淀为7.8 g。试求所加 NaOH 溶液的物质的量浓度。
(2)往100 mL 2 mol/L 的AlCl3溶液中逐滴加入 NaOH 溶液 100 mL 时,产生沉淀为7.8 g。试求所加 NaOH 溶液的物质的量浓度。
(1)1.0 1.5 (2)3.0 mol/L或7.0mol/L
试题分析:(1)混合前硫酸铜的浓度是2.0mol/L
所以混合物后硫酸铜的浓度是2.0mol/L÷2=1.0mol/L
溶液中c(SO42-)=

(2)氯化铝的物质的量是0.2mol
则最多生成氢氧化铝的质量是0.2mol×78g/mol=15.6g
实际生成的氢氧化铝是7.8g÷78g/mol=0.1mol
所以如果氯化铝过量
则根据方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl可知
需要氢氧化钠的物质的量是0.3mol
则氢氧化钠溶液的浓度是0.3mol÷0.1L=3.0mol/L
如果氢氧化钠过量,又溶解一部分氢氧化铝
则根据反应的方程式Al(OH)3+NaOH=NaAlO2+2H2O可知
需要氢氧化钠的物质的量是0.6mol+(0.2mol-0.1mol)=0.7mol
则氢氧化钠溶液的浓度是0.7mol÷0.1L=7.0mol/L
点评:该题是中等难度的试题,试题难易适中,注重对学生基础知识的考查和巩固,有利于培养学生的逻辑推理能力和发散思维能力,也有助于培养学生的规范答题能力。该题的难点是氢氧化铝的制备计算,关键是要明确氢氧化铝的两性,然后利用数学中的讨论法进行分析、判断即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 表示阿伏加德罗常数的值。下列判断错误的是( )
表示阿伏加德罗常数的值。下列判断错误的是( ) 的质量为1 g
的质量为1 g 溶液中含
溶液中含
 中含有
中含有 个氧原子
个氧原子 中含有
中含有