题目内容
【题目】根据下列转化关系(反应条件略去),A、B、C、D中均含有同一种元素,回答下头问题:
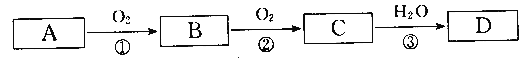
(1)若A为Na,写出反应③的化学方程式___________________________
(2)若A为N2,写出反应③的离子方程式___________________________
(3)若A为S,写出D的浓溶液与Cu在加热情况下反应的化学方程式_________________
(4)若A为NH3,写出过量Fe与D的稀溶液反应(还原产物只有B)的离子方程式_____________________________,将14 g铜、银合金与一定量某浓度的D溶液完全反应,将放出的气体与1.12 L(标准状况)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是________g。
【答案】 2Na2O2+2H2O=4NaOH+O2↑ 3NO2+H2O=2HNO3+NO Cu+2H2SO4(浓)![]() CuSO4+ SO2↑+2H2O 3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O 3.2
CuSO4+ SO2↑+2H2O 3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O 3.2
【解析】(1)若A为Na,钠与氧气反应生成B为氧化钠,氧化钠与氧气反应生成C为过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,故反应③的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;(2)若A为N2,氮气与氧气反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,故反应③的离子方程式为3NO2+H2O=2HNO3+NO;(3)若A为S,硫与氧气反应生成二氧化硫,二氧化硫与氧气催化氧化生成三氧化硫,三氧化硫与水反应生成硫酸,则D的浓溶液浓硫酸与Cu在加热情况下反应的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+ SO2↑+2H2O;(4)若A为NH3,氨气与氧气反应生成一氧化氮和水,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,故过量Fe与稀硝酸反应(还原产物只有NO)的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,n(O2)=
CuSO4+ SO2↑+2H2O;(4)若A为NH3,氨气与氧气反应生成一氧化氮和水,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,故过量Fe与稀硝酸反应(还原产物只有NO)的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,n(O2)=![]() =0.05mol,设Cu、Ag的物质的量分别为x、y,则:根据质量列方程:x×64g/mol+y×108g/mol=14g,根据电子守恒列方程:2x+1×y=0.05mol×4 ,解得:x=0.05mol,y=0.1mol ,m(Cu)=0.05mol×64g/mol=3.2g。
=0.05mol,设Cu、Ag的物质的量分别为x、y,则:根据质量列方程:x×64g/mol+y×108g/mol=14g,根据电子守恒列方程:2x+1×y=0.05mol×4 ,解得:x=0.05mol,y=0.1mol ,m(Cu)=0.05mol×64g/mol=3.2g。

