题目内容
(14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:

其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是
(4)D—→C反应的化学方程式是
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。

其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是
(4)D—→C反应的化学方程式是
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
(16分,每小题2分)
(1) C
(2) AlO2— + NH3
(3) 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+
(4) 4 NH3 +5O2 ="=" 4NO + 6 H2O
(5) N2
(6) 3NO2 + H2O ="=" 2HNO3 + NO
(7) 1:1
(1) C
(2) AlO2— + NH3
(3) 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+
(4) 4 NH3 +5O2 ="=" 4NO + 6 H2O
(5) N2
(6) 3NO2 + H2O ="=" 2HNO3 + NO
(7) 1:1
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,根据图示信息可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸.
(1)Al+4HNO3=Al(NO3)3+NO↑+2H2O,HNO3中的氮部分变价,同时表现强氧化性及酸性,选C;故答案为:C。
(2)由原子守恒和得失电子守恒得:碱性条件下铝以AlO2―形式存在,氨气催化氧化可以生成一氧化氮和水,故答案为: AlO2— + NH3
⑶过量的氨水不能溶解Al(OH)3, 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+发生反应生成氢氧化铝白色沉淀,故答案为: 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+
(4)D—→C反应的化学方程式:氨气催化氧化生成一氧化氮和水4 NH3 +5O2 ="=" 4NO + 6 H2O故答案为:4 NH3 +5O2 ="=" 4NO + 6 H2O
(5)6NO+4NH3=5N2+6H2O,8NH3+6NO2=5N2+12H2O,无毒氧化为N2, 故答案为: N2
⑹可以用水洗法,3NO2 + H2O ="=" 2HNO3 + NO,故答案为:3NO2 + H2O ="=" 2HNO3 + NO
⑺Al与NO3-在酸性条件下反应,金属铝被氧化为三价的铝离子,失去电子3mol,硝酸根被还原为一氧化氮,得到电子也是3mol,根据电子守恒,Al与被还原的NO3-的物质的量之比是1:1,故答案为:1:1.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

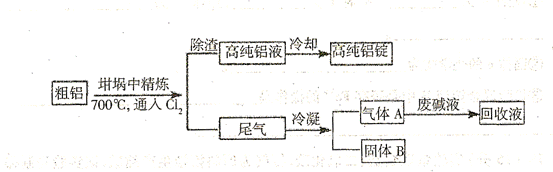
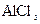 在181℃升华)
在181℃升华) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①
精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①  和② 。
和② 。  连续通人坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除
连续通人坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除 为a g,则此合金中铝的质量分数为( )
为a g,则此合金中铝的质量分数为( ) 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题: