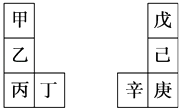
题目内容
【题目】第二、三周期元素X,Y,Z,W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( ) 
A.W的氧化物对应的水化物必是强酸
B.X的原子半径比As原子半径小,两者原子序数之差为29
C.Z的氧化物可与Y的氢化物水溶液不会发生化学反应
D.图中五种元素均是非金属元素,并且Y的非金属性最强
【答案】D
【解析】解:由第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系图,可知X为第二周期第ⅢA族元素,即X为B,则Y为F,Z为Si,W为S,
A.W的氧化物对应的水化物可能为硫酸或亚硫酸,而亚硫酸为弱酸,故A错误;
B.电子层多的原子半径大,二者原子序数分别为5、33,二者原子序数差为33﹣5=28,故B错误;
C.二氧化硅与HF酸反应,生成四氟化硅和水,故C错误;
D.B、F、Si、S、As均为非金属元素,F的非金属性最强,即Y的非金属性最强,故D正确;
故选D.

练习册系列答案
相关题目