题目内容
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,22.4L氯气溶于水转移电子数为NA | |
| B. | 1L 0.1mol/L的硫酸铁溶液中含有铁离子的数目为0.2NA | |
| C. | 向氨气合成塔中通入amolN2和3amolH2的混合气,充分反应后生成N-H数为6aNA | |
| D. | 电解硫酸铜溶液时,当阳极产生22.4L(标况)气体,体系中转移电子数为4NA |
分析 A.氯气与水反应时可逆反应,只有部分氯气与水反应生成氯化氢和次氯酸;
B.Fe3+离子能发生水解;
C.合成氨的反应是可逆反应,反应不能进行到底;
D.电解硫酸铜溶液时,阳极生成的气体为氧气,生成1mol氧气需要得到4mol电子.
解答 解:A.氯气与水反应时可逆反应,只有部分氯气与水反应生成氯化氢和次氯酸,故标准状况下,22.4L氯气溶于水转移电子数小于NA,故A错误;
B.Fe3+离子能发生水解,故1L1mol•L-1硫酸铁溶液中含有Fe3+离子数目小于0.2NA,故B错误;
C.合成氨的反应时可能反应,故氨气合成塔中通入amolN2和3amolH2的混合气,充分反应后生成N-H数小于6NA,故C错误;
D.电解硫酸铜溶液时,阳极产生的气体为氧气,22.4L(标况)气体的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,生成1mol氧气需要得到4mol电子,电路中转移电子数为4NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的应用,难度中等.A为易错点,注意氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸.

练习册系列答案
相关题目
3.下列各组离子中,在给定条件下能够大量共存的是( )
| A. | 通入足量CO2后的溶液中:Na+、SO32-、CH3COO-、HCO3- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Fe2+、NO3-、Cl- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
10.国务院于2011年2月正式批复《浙江海洋经济发展示范区规划》,浙江海洋经济发展示范区建设上升为国家战略.建设好浙江海洋经济发展示范区关系到我国实施海洋发展战略和完善区域发展总体战略的全局.关于海水利用的下列说法不正确的是( )
| A. | 海水有“元素故乡”之称,溴被称为“海洋元素” | |
| B. | 发展氯碱工业是利用海水的一大方向,其中氯气是氧化产物,H2是还原产物 | |
| C. | 工业上从海水中获取NaCl和AlCl3,通过电解其熔融盐可获得金属Na和Al | |
| D. | 利用海水通过物理变化可以获得淡水和食盐,但从海水中获取MgCl2和Br2必须通过化学变化 |
20.下列离子方程式正确的是( )
| A. | 钢铁发生吸氧或析氢腐蚀时,铁均作负极被氧化:Fe-3e-═Fe3+ | |
| B. | SO2气体通入Fe2(SO4)3溶液中:SO2+2H2O+2Fe3+═2Fe2++4H++SO42- | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Cu+O2↑+4H+ | |
| D. | Na2S溶液使酚酞变红:S2-+2H2O?2OH-+H2S |
7.在下列条件下,能大量共存的离子组是( )
| A. | c(H+)=1×10-14mol/L的无色溶液:K+、S2-、MnO4-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、Fe2+、NO3- |
4.化学与生产、生活密切相关,下列说法不正确的是( )
| A. | 16O2与18O2互为同位素,它们的性质基本相同 | |
| B. | 多糖、油脂、蛋白质在一定条件都能发生水解反应 | |
| C. | 玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片 |
5.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.1mol苯分子中含有双键数为0.3NA | |
| B. | 1L1mol•L-1碳酸钠溶液中阴离子的数目大于NA | |
| C. | 标准状况下,22.4L乙烷中共含有分子数为NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,转移的电子的数目为0.92NA |
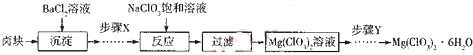
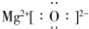 .
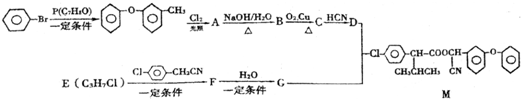
.
 .
.