题目内容
19.下列分子或离子在指定的分散系中能大量共存的一组是( )| A. | 潮湿的空气:N2、O2、CH4、NO2 | |
| B. | 氢氧化铝胶体:Na+、Cu2+、NO3-、MnO4- | |
| C. | 饱和溴水:NH4+、K+、Cl-、C2H5OH | |
| D. | 福尔马林溶液:K+、H+、SO42-、Cr2O72- |
分析 A.二氧化氮能够与空气中的水、氧气反应生成硝酸;
B.氢氧化铝胶体遇电解质溶液发生聚沉;
C.四种物质直接不反应,都不与溴单质反应;
D.福尔马林为甲醛溶液,酸性条件下重铬酸根离子能够氧化甲醛.
解答 解:A.O2、NO2在潮湿的空气中能够发生反应生成硝酸,不能大量共存,故A错误;
B.氢氧化铝遇到电解质溶液会发生聚沉现象,不能大量共存,故B错误;
C.NH4+、K+、Cl-、C2H5OH之间不反应,都不与溴反应,能够大量共存,故C正确;
D.H+、Cr2O72-具有强氧化性,能够氧化甲醛,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,明确常见物质的性质为解答关键,注意掌握离子反应发生条件,明确题中隐含条件的含义,试题培养了学生的分析能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
9.在A、B、C、D四个烧杯内分别放入0.1mol的Na、Na2O、Na2O2、NaOH,然后各加入100mL H2O,搅拌使固体完全溶解,则A、B、C、D的质量分数大小顺序为( )
| A. | A<B<C<D | B. | D<A<B=C | C. | A=D<B=C | D. | D<A<B<C |
10.下列化合物分别跟溴在铁粉作催化剂的条件下反应,苯环上的氢原子被取代,所得一溴代物有三种同分异构体的是( )
①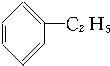 ②
②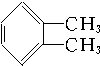 ③
③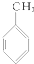 ④
④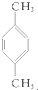
①
 ②
② ③
③ ④
④
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
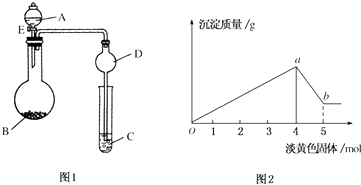
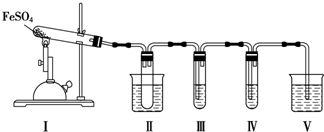
7.FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学研究小组为探究在酒精喷灯加热条件下FeSO4分解的气体产物,进行了一系列实验.已知SO3的熔点是16.8℃,沸点是44.8℃.
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
(3)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄.
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.

请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.
4.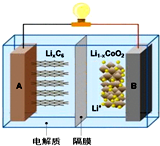 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )| A. | 放电时电子从A极通过导线流向B极有关 | |
| B. | 放电时A是负极,电极反应式为:LixC6-xe-=C6+xLi+ | |
| C. | 充电时Li+从左边流向右边 | |
| D. | 充电时B作阳极,电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+ |
8.下列有关实验操作说法中,正确的是( )
①用pH试纸测得氯水的pH为2
②仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可以鉴别pH相等的H2SO4和CH3COOH溶液
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体.
①用pH试纸测得氯水的pH为2
②仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可以鉴别pH相等的H2SO4和CH3COOH溶液
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体.
| A. | ①③⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④⑥ |
9.分类是化学学习和研究中的常用手段,下列分类依据和结论都正确的是( )
| A. | 浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸 | |
| B. | Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属于电解质 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属于离子化合物 | |
| D. | 金刚石、二氧化硅、碳化硅晶体中原子间均以共价键结合,都属于原子晶体 |