题目内容
氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是 ( )。
| A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| B.通常状况下,干燥的氯气能与Fe反应 |
| C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸 |
| D.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
B
解析

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用。下面化学反应不符合绿色化学概念的是
| A.消除硫酸厂尾气排放:SO2+2NH3 = (NH4)2SO3 |
| B.消除制硝酸工业尾气排放:NO2+NO+2NaOH =2NaNO2+H2O |
| C.制CuSO4:Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O |
| D.制CuSO4:2Cu+O2= 2CuO CuO+H2SO4(稀) = CuSO4+H2O |
检验试管中盛有的少量白色固体是铵盐的方法是( )
| A.将固体加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
| B.加水溶解,用PH试纸测溶液的酸碱性 |
| C.加入NaOH溶液,加热,再滴入酚酞试液 |
| D.加入NaOH溶液,加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
下列说法正确的是( )
| A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 |
| B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 |
| C.硫粉在过量的纯氧中燃烧可以生成大量的SO3 |
| D.富含硫黄的矿物在工业上可用于制造硫酸 |
下列物品或设备:①水泥路;②门窗玻璃;③水晶镜片;④石英钟表;⑤玛瑙手镯;⑥硅太阳能电池;⑦光导纤维;⑧计算机芯片。所用材料含有SiO2的( )。
| A.①②③④⑤⑦ | B.①②⑦⑧ | C.⑥⑧ | D.全部 |
据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可制备出超高强度的高性能混凝土。下列关于二氧化硅的说法中,正确的是( )
| A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物 |
| B.将二氧化碳通入硅酸钠溶液可以得到硅酸 |
| C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 |
| D.二氧化硅是酸性氧化物,它不溶于任何酸 |
在氯水中存在着如下反应:Cl2+H2O=HCl+HClO,因此氯水中存在多种分子和离子。在下列实验现象中与相应离子或分子性质关系正确的是( )
| A.氯水有刺激性气味说明氯水中有HCl |
| B.氯水中滴入品红溶液,溶液为无色说明氯水中有Cl2 |
| C.向氯水中通入SO2气体,氯水黄绿色褪去说明Cl2发生了反应 |
| D.向氯水中加入CaCO3有气泡产生,说明有HCl和HClO |
下列与含氯化合物有关的说法正确的是 ( )
| A.HClO是弱酸,所以NaClO是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
下列反应中氯元素被氧化的是( )
A.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
B.2HCl+Ca(OH)2 CaCl2+2H2O CaCl2+2H2O |
C.5Cl2+I2+6H2O 10HCl+2HIO3 10HCl+2HIO3 |
D.2KClO3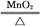 2KCl+3O2↑ 2KCl+3O2↑ |