题目内容
下列叙述正确的是
| A.非金属原子间以共价键结合的物质都是共价化合物 |
| B.含有共价键的化合物都是共价化合物 |
| C.凡是能电离出离子的化合物都是离子化合物 |
| D.凡是含有离子键的化合物都是离子化合物 |
D
解析试题分析:A.非金属原子间以共价键结合的物质可能是单质如H2、N2、O3等,也可能是共价化合物H2O、CH4、CO2等。错误。B.共价键存在与单质,如N2、O2;共价化合物如H2O、HCl;离子化合物。如NaOH、Na2O2等。所以含有共价键的化合物不一定共价化合物。错误。C.各种金属都含有金属阳离子和自由电子。因此能电离出离子的化合物不一定是离子化合物。D.离子化合物一定都含有离子键,可能含有共价键。所以含有离子键的化合物都是离子化合物。正确。
考点:考查化学键与化合物的关系的知识。

练习册系列答案
相关题目
下列物质属于共价化合物的是
| A.C60 | B.CaCl2 | C.NH4NO3 | D.C6H6 |
下列说法正确的是( )
| A.若把H2S分子写成H3S分子,违背了共价键的饱和性 |
| B.晶体中若有阳离子一定有阴离子 |
| C.金属键存在于任何含金属元素的物质中 |
| D.晶体中一定存在化学键 |
下列物质只含有离子键的是
| A.CO2 | B.NaOH | C.MgCl2 | D.H2O |
下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子
后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是( )
| A | B | C | D |
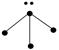 |  | 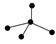 |  |
| NH3 | C2H4 | CCl4 | CO2 |
下列说法正确的是( )。
| A.离子键就是阴、阳离子间的静电引力 |
| B.所有金属元素与所有非金属元素间都能形成离子键 |
| C.钠原子与氯原子结合成氯化钠后体系能量降低 |
| D.在离子化合物CaCl2中,两个氯离子间也存在离子键 |
下列各分子中,所有原子都满足最外层8电子稳定结构的是( )。
| A.H2O | B.BF3 | C.CCl4 | D.PCl5 |
观察下表模型并结合有关信息,判断下列说法中不正确的是( )
| | B12结构单元 | SF6分子 | S8分子 | HCN |
| 结构模型示意图 | 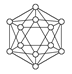 | 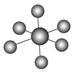 | 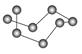 | 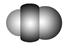 |
| 备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
下列说法中正确的是( )。
| A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子 |
| B.NH3、H2O、CH4分子的几何构型均为三角锥形 |
| C.NH3、H2O、CH4分子中的N、O、C原子均是采取sp2杂化的 |
| D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1 |