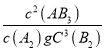题目内容
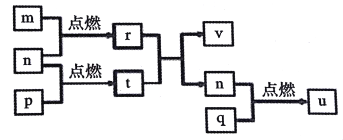
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、3molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | V甲 | v乙 | v丙 |
下列说法正确的是( )
A. K乙<K丙 B. c乙=c丙 C. a甲 +a乙<1 D. v甲=v丙
【答案】C
【解析】1mol A2、3molB2 相当于 2molAB3;甲与丙起始温度和起始体积相同,恒温条件下,丙在恒压条件下分解2molAB3,平衡时体积比反应前大,即平衡时丙的体积大于甲,则平衡时气体的压强丙小于甲,即v甲>v丙;D错误;乙为绝热恒容,丙为恒温,所以乙反应后比丙的温度低,向吸热方向进行的程度小,平衡时乙中AB3浓度比丙高,即c乙>c丙,B错误;甲和乙均为恒温容器,如果都是恒温,则a甲 +a乙=1,现在乙为绝热容器,所以乙反应后比甲温度低,向吸热方向进行的程度小,所以转化率减小,因此a甲 +a乙<1,C正确;乙绝热容器,丙恒温,所以乙反应后比丙温度低,向吸热方向进行的程度小,平衡时AB3浓度比丙高,A2、B2浓度比丙低,K乙>K丙 A错误;正确选项C。

【题目】观察下列比例模型,每个模型表示的分子均由C、H、O中的两种或三种构成。对各模型表示的物质的相关叙述正确的是( )
比例模型 | 对模型表示的物质的相关叙述 | |
A |
| 将形状、大小均相同的金属钠分别投入盛有0.1 mol/L的该物质的水溶液、无水乙醇和水的烧杯中,盛该物质的烧杯中产生气泡的速率最慢 |
B |
| 将灼热的铜丝反复插入盛有该物质的试管中,观察到铜丝由黑色变为光亮的红色并产生有刺激性气味的物质。此反应体现了该物质的氧化性 |
C |
| 在分液漏斗中加入该物质与碘水的混合液,充分振荡,碘水褪色,此时发生了取代反应 |
D |
| 该物质及其碳原子数小于10的同系物中,一氯代物只有一种(不考虑立体异构)的物质共有4种 |
A. A B. B C. C D. D