题目内容
【题目】实验室用0.100 mol·L-1 Na2C2O4溶液标定KMnO4溶液浓度的步骤为
①取10.00 mL KMnO4溶液酸化;
②用标准液滴定至滴定终点,平均消耗标准液体积为25.00 mL。
下列说法正确的是( )
A. “酸化”可用盐酸
B. 滴定终点的现象为溶液恰好变为红色,半分钟不变色
C. KMnO4溶液的浓度为 0.004 mol·L-1
D. 滴定反应中转移电子的数目为3.01×1021
【答案】D
【解析】高锰酸钾能氧化氯化氢,不能用盐酸酸化高锰酸钾溶液,故A错误;滴定终点的现象为溶液恰好变为无色,半分钟不变色,故B错误;根据Na2C2O4与KMnO4反应的物质的量比为5:2,KMnO4溶液的浓度为![]() =0.1 mol·L-1,故C错误;滴定反应中转移电子的数目为
=0.1 mol·L-1,故C错误;滴定反应中转移电子的数目为![]() 3.01×1021,故D正确。
3.01×1021,故D正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某科研小组利用工业废料(主要成分NiO,含有少量Al2O3、FeO、CuO、BaO)回收NiO,并制备其他部分产品的工艺流程如下:

已知:①溶液中离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
②25℃时,部分难溶物的溶度积常数如下表所示:
难溶物 | CuS | Al(OH)3 | Ni(OH)2 | Fe(OH)3 | Fe(OH)2 |
溶度积常数(Ksp) | 6.3×10-36 | 1.3×10-33 | 2.0×10-15 | 4.0×10-38 | 1.8×10-16 |
请回答下列问题:
(1)H2S的电子式为_______________________________。
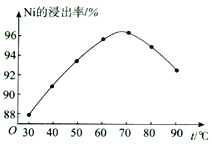
(2)“酸浸”时,Ni的浸出率与温度的关系如图所示。 温度高于70℃,Ni的浸出率降低的主要原因为___________________________________________________________。
(3)“沉淀1”的主要成分为____________________(填化学式)。
(4)“滤液1”中通入H2S的作用为___________________。
(5)“转化”过程中,发生反应的主要离子方程式为________________________________。
(6)25℃时,“调节pH2”使沉淀3中金属阳离子沉淀完全后,所得溶液中的C(H+)最大为____________(保留三位有效数字,已知![]() ≈1.4)。
≈1.4)。
(7)“操作I”主要包括蒸发浓缩、__________________、过滤、洗涤、干燥。
(8)NiO可通过铝热反应冶炼Ni,该反应的化学方程式为________________________________。