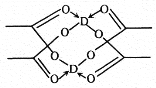
题目内容
【题目】常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是( )

A.甲胺在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH—
CH3NH3++OH—
B.b点对应的加入盐酸的体积小于20mL
C.a点对应的溶液中c(CH3NH2)< c(CH3NH3+)
D.常温下,甲胺的电离常数为Kb,则pKb=—lgKb=3.4
【答案】C
【解析】
A、甲胺(CH3NH2)类似于氨,但碱性稍强于氨,说明甲胺是一元弱碱,在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH-,选项A正确;
CH3NH3++OH-,选项A正确;
B、若加入20mL的盐酸,则盐酸和甲胺恰好完全反应生成CH3NH3Cl溶液,CH3NH3Cl是强酸弱碱盐,所得溶液呈酸性,b点溶液呈中性,所以b点对应加入盐酸的体积小于20mL,选项B正确;
C、a点lg =0,
=0,![]() =
=![]() ,选项C不正确;
,选项C不正确;
D、由甲胺的电离方程式CH3NH2+H2O![]() CH3NH3++OH-可知,甲胺的电离常数为Kb=
CH3NH3++OH-可知,甲胺的电离常数为Kb=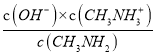 ,a点溶液的pH=10.6,c(OH-)=10-3.4,lg
,a点溶液的pH=10.6,c(OH-)=10-3.4,lg =0,则pKb=-lgKb=-lg
=0,则pKb=-lgKb=-lg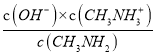 =-lgc(OH-)-lg
=-lgc(OH-)-lg =- lgc(OH-)=3.4,选项D正确;
=- lgc(OH-)=3.4,选项D正确;
答案选C。

【题目】(1)现有反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式_____________________________;

(2)已知该反应中相关的化学键键能数据如图所示,则C≡O中的键能为_____kJmol﹣1;图中曲线Ⅱ表示____________(填反应条件)的能量变化。
化学键 | H﹣H | C﹣O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 465 | 413 |
(3)图中数字“419”表示的是_________________________;
(4)下列反应中,属于放热反应的是_______ (填编号,下同),属于吸热反应的是_______;
①物质燃烧;②炸药爆炸;③酸碱中和反应;④二氧化碳通过炽热的碳;⑤食物因氧化而腐败;⑥Ba(OH)28H2O与NH4Cl反应;⑦铁粉与稀盐酸反应。