题目内容
【题目】A、B、C、X是中学化学中常见的4种物质,它们均由短周期元素组成,转化关系如图所示。请针对以下两种情况回答下列问题。
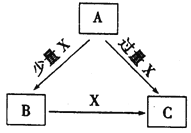
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得白色胶状沉淀B。
① A中含有的金属元素为__________(填元素名称)。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨,此反应的化学方程式为:__________。
(2)若A、B、C的焰色反应均呈黄色,水溶液均呈碱性。
① A中所含有的化学键是________、__________。
②将4.48 L(标准状况下)X通入100 mL3 mol/LA的水溶液后,溶液中离子浓度由大到小的顺序为__________。
③自然界中存在由B或C与H2O按一定比例结晶而成的固体。将一定置的由C与H2O按一定比例形成的晶体溶于水配制成100 mL溶液,测得溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的此晶体加热至恒重,剩余固体的质量为________________。
【答案】(1)①铝(1分)②2Al+Fe2O3![]() Al2O3+2Fe(2分)
Al2O3+2Fe(2分)
(2)①离子键(1分)共价键(1分)
②c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(2分)③2.65g(2分)
【解析】
试题分析:(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠。
①A、B、C中含有的同一种常见金属元素为Al;
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨,此反应是铝热反应,反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,X为二氧化碳;
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是 离子键、共价键;
②将4.48 L(0.2mol)(标准状况下)CO2通入100mL 3 mol/L NaOH的水溶液后,溶液为Na2CO3、NaHCO3等浓度混合溶液,CO32―水解能力强于HCO3―,各离子浓度关系为:c(Na+)>c(HCO3-)>c(CO32- )>c(OH-)>c(H+);
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol·L-1,即钠离子浓度为0.5mol·L-1,取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为1/2×0.1L×0.5mol·L-1×106g·mol-1=2.65g。

 同步奥数系列答案
同步奥数系列答案
