题目内容
【题目】硫及其化合物广泛存在于自然界中。
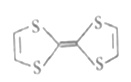
(1)四硫富瓦烯分子结构如图所示,其碳原子杂化轨道类型为_________,根据电子云的重叠方式其含有的共价键类型为___________,1mol四硫富瓦烯中含有σ键数目为__________。
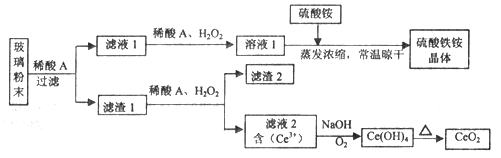
(2)煅烧硫铁矿时发生的反应为FeS2+O2![]() Fe2O3+SO2,所得产物SO2再经催化氧化生成SO3,SO3被水吸收生成硫酸。
Fe2O3+SO2,所得产物SO2再经催化氧化生成SO3,SO3被水吸收生成硫酸。
①基态S原子存在____________对自旋方向相反的电子。
②离子化合物FeS2中,Fe2+的电子排布式为__________,与S22-互为电子体的离子是____________。
③气体SO3分子的空间构型为__________,中心原子阶层电子对数为____________。
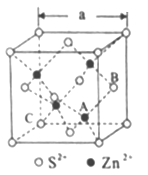
(3)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如下图所示),Zn属于_______区元素,在立方ZnS晶体结构中S2-的配位数为______________,若立方ZnS晶体的密度为ρg·cm-3,晶胞参数a=______nm(列出计算式),晶胞中A、B的坐标分别为A(![]() ,
, ![]() ,
, ![]() )、B(
)、B(![]() ,
, ![]() ,
, ![]() ),则C点的坐标为____________。
),则C点的坐标为____________。
【答案】 sp2 σ键和π键 15NA 7 1s22s22p63s23p63d6(或[Ar]3d6) O22- 平面三角形 3 )ds 4 ![]() (0. 0. 0.)
(0. 0. 0.)
【解析】(1)根据四硫富瓦烯分子结构可判断碳原子均形成碳碳双键,碳原子杂化轨道类型为sp2,根据电子云的重叠方式其含有的共价键类型为σ键和π键。单键均是σ键,双键中含有1个σ键和1个π键,则1mol四硫富瓦烯中含有σ键数目为15NA。(2)①基态S原子的核外电子排布为1s22s22p63s23p4,存在7对自旋方向相反的电子。②铁的原子序数是26,Fe2+的电子排布式为1s22s22p63s23p63d6(或[Ar]3d6)。原子数和价电子数分别都相等的是等电子体,则与S22-互为电子体的离子是O22-。③SO3分子中硫原子不存在孤对电子,价层电子对数是3,气体SO3分子的空间构型为平面三角形,中心原子阶层电子对数为3。(3)区的名称来自于按照构造原理最后填入电子的轨道名称,Zn属于ds区元素。在立方ZnS晶体结构中S2-的配位数为4。ZnS晶胞中的晶胞参数为anm,则晶胞的体积为(a×10-6cm)3,晶胞中含有4个ZnS,则1mol晶胞的质量为97×4g,1mol晶胞的体积为(a×10-7cm)3×6.02×1023,则ZnS晶体的密度为ρg·cm-3=(97×4g)÷[(a×10-7cm)3×6.02×1023],解得a=![]() nm。晶胞中C位于顶点处,C点的坐标为(0,0,0)。
nm。晶胞中C位于顶点处,C点的坐标为(0,0,0)。

 阅读快车系列答案
阅读快车系列答案【题目】C、N、S对应的化合物,是重要的化学物质。试回答下列问题:
(1)已知:氢气的燃烧热为286.0kJ/mol,氨气的燃烧热为382.5 kJ/mol ,则合成氨反应的热化学方程式
为_____________________。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为________________。
(3)用活性炭还原法处理氮氧化物。 有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T)条件下反应,反应进行到不同时间测得各物质的浓度如表:
时间(min) 浓度(molL-1) | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
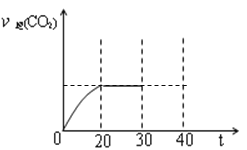
①10min~20min以v(CO2)表示的反应速率为_________________。
②根据表中数据,计算T℃时该反应的平衡常数为Kp=___________,(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留两位小数)
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率_________(填“增大”“不变”或“减小”)。
④该反应达到平衡时下列说法正确的是______填序号字母)。
a.容器内压强保持不变 b.2v(NO)=v(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
⑤30min时改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是______。请在图中画出30~40min的变化曲线______。