题目内容
【题目】为了验证凯库勒有关苯环结构的观点,甲同学设计了如下实验方案。
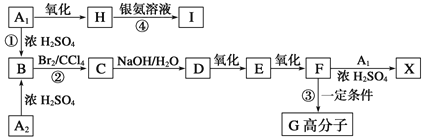
①按如图所示的装置图连接好各仪器;

②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;
④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题。
(1)A中所发生反应的反应类型为_________,能证明凯库勒观点错误的实验现象是_______。
(2)装置B的作用是__________。
(3)C中烧瓶的容积为500 mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对H2的相对密度为37.9,则实验结束时,进入烧瓶中的水的体积为________mL(空气的平均相对分子质量为29)。
(4)实验前应对A、B、C三个装置的气密性进行逐一检查,则检查装置C气密性的操作为________。
【答案】取代反应 C中产生“喷泉”现象 除去未反应的苯蒸气和溴蒸气 450 关闭K2打开K3,将装置C中导管b的下端插入水中,双手捂热烧瓶,若观察到导管口有气泡产生,则说明装置C的气密性良好
【解析】
(1)苯与溴在溴化铁做催化剂的条件下发生取代反应,生成溴苯和溴化氢;
(2)由于反应放热,苯和液溴均易挥发,溴的存在干扰检验H+和Br-;
(3)根据相对密度进行计算;
(4)根据装置气密性检验的原理解答.
(1)在烧瓶A中,苯与溴在溴化铁作催化剂的条件下生成溴苯和溴化氢,苯分子里的氢原子被溴原子所代替,该反应为取代反应,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,证明反应不是加成反应,所以苯分子中不存在碳碳单双键交替,凯库勒观点错误;
(2)由于苯与液溴发生的取代反应是放热反应,反应放出热量,使苯和液溴均易挥发,进入到反应产生的HBr气体中,可根据苯和溴极易溶于四氯化碳的性质,用四氯化碳除去溴化氢气体中的未反应的溴蒸气和苯,以防干扰检验H+和Br-的存在;
(3)烧瓶中混合气体对H2的相对密度为37.9,故烧瓶中混合气体的平均分子量为M=37.9×2=75.8,设HBr的体积为x,空气的体积为y,则:![]() =75.8,x+y=500,解得x=450 mL,y=50 mL,进入烧瓶中水的体积为HBr的体积,故进入烧瓶中的水的体积为x=450 mL;
=75.8,x+y=500,解得x=450 mL,y=50 mL,进入烧瓶中水的体积为HBr的体积,故进入烧瓶中的水的体积为x=450 mL;
(4)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏,所以检查装置C的气密性的操作为关闭K2,打开K3,将装置C中的b导管插入水中,双手握住烧瓶,若观察到b导管口有气泡产生,则装置C的气密性好。

【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
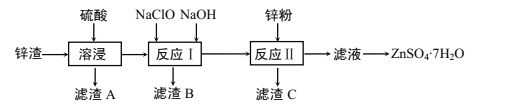
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O