��Ŀ����
����Ŀ����֪��ʵ����������������������Ҵ���Ũ�����Ʊ�1��2�����������װ����ͼ��ʾ�����п��ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѡ��й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | -130 | 9 | -116 |
�ش��������⣺
��1��������������������Ҵ���Ũ�����Ʊ�1��2���������������������У���һ����Ҫ�ڱ�ˮԡ�»��Ũ������Ҵ������ʱ�����Լ���˳����___��ʹ�ñ�ˮԡ���µ�Ŀ����___���ڶ�����Ӧ�Ļ�ѧ����ʽ___��
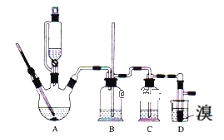
��2���ڴ�ʵ���У�Ҫ��A�м���___����ֹ___����Ӧ�¶���ߵ�170�����ң�������ҪĿ����___������ȷѡ��ǰ����ĸ����
a��������Ӧ b���ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��3��װ��B��������___����װ��C��Ӧ����__����Ŀ�������շ�Ӧ�п������ɵ��������壨����ȷѡ��ǰ����ĸ����
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��4���ж�D�з�Ӧ�����ķ�����___����D��1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��___�㣨��ϡ������¡�����
��5�������������������������ѣ�����___�ķ�����ȥ��
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ������ϩ���巴Ӧʱ���ȣ���ȴ�ɱ�����Ĵ����ӷ������ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����__��
���𰸡����Ҵ���Ũ���� ��ֹ�Ҵ��ӷ� CH2=CH2+Br2��CH2BrCH2Br ��ʯ ������ d ƽ����ѹ���Ŷ��� c ����ȫ��ɫ �� ���� ������ȴ��ʹ�����̶�ʹ��·���ܣ�����
��������
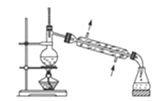
װ��A���Ҵ���Ũ����Ĵ�������170����ˮ������ϩ��Ũ�����ǿ�����ԡ���ˮ�Ե����г�����ϩ�����к������ʶ�����������̼��ˮ���������ʣ�ͨ��װ��B�г�������Һ���������½�����װ����ѹǿ��BΪ��ȫƿ�����Է�ֹ����������E������Һ��ߵͱ仯�������ж��Ƿ���������������̼�����������ܺ�����������Һ��Ӧ��װ��C����������������Һ�����������壬���ڳ����£��ӷ�����ϩ���巴Ӧʱ���ȣ�����ӷ���װ��D��ȴ�ɱ�����Ĵ����ӷ�����1��2-������������̵�9��ϵͣ����ܹ�����ȴ�������ʹ��Ʒ���̶��������ܣ�1��2-���������ˮ�����ܣ�1��2-���������ܶȱ�ˮ�����Լ�ˮ�����ã�����Ӧ���²㣬����õ���Ʒ���Դ˽����⡣
(1)Ũ������ܶȱ��Ҵ������ܽ�ʱ���ȣ������ƻ��Һʱ���Ҵ���Ũ���������������������Ҵ���Ũ�����Ʊ�1��2-�������������������У���Ӧԭ�����£���һ����ӦΪCH3CH2OH![]() CH2 = CH2��+ H2O���ڶ�����ӦΪCH2=CH2+Br2��BrCH2CH2Br��
CH2 = CH2��+ H2O���ڶ�����ӦΪCH2=CH2+Br2��BrCH2CH2Br��
(2)Һ����Һ����ʱ��Ҫ�������Ƭ���ʯ���Է�ֹ���У��Ҵ���Ũ����140��������£�������������ˮ�������ѣ�����Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ���ǣ����ٸ������������ɣ��ʴ�Ϊ��d��
(3)ʹ��װ��B��ƽ����ѹ����ֹװ��C��D�е��ܶ�����Ũ�������ǿ�����ԣ����Ҵ������ɶ�����̼����������ԭ�ɶ�����������̼�����������ܺ�����������Һ��Ӧ�������գ�����Ⱦ�������ʴ�Ϊ��c��
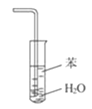
(4)��ϩ��ʹD��Һ����ɫ����D������ȫ��ɫʱ����˵����Ӧ��������D��1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã���1��2-���������ˮ�����ܣ���1��2-���������ܶȱ�ˮ�������Ӧ���²㣻
(5)1��2-�������������ѵķе㲻ͬ�����߾�Ϊ�л�����ܣ�������ķ��������Ƿ��룻
(6)���ڳ����£��ӷ�����ϩ���巴Ӧʱ���ȣ�����ӷ�����ȴ�ɱ�����Ĵ����ӷ�����1��2-������������̵�9��ϵͣ����ܹ�����ȴ��������ȴ��ʹ�����̶�ʹ��·������B�г�������Һ��������

����Ŀ���Ȼ���ͭ��һ����Ҫ�Ļ���ԭ�ϣ�һ�����õ�Ʒλͭ��![]() ��Ҫ����Cu2S��CuS��FeO��Fe2O3��SiO2��
��Ҫ����Cu2S��CuS��FeO��Fe2O3��SiO2��![]() Ϊԭ����ȡCuCl�Ĺ����������£�
Ϊԭ����ȡCuCl�Ĺ����������£�
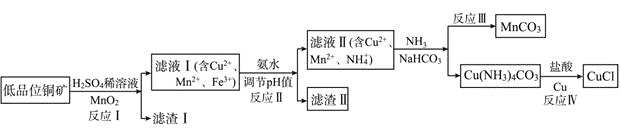
(1)��Ӧ������ȡ��ǰ�轫ͭ������Ŀ����___________________________��
(2)�������ijɷֳ�S��![]() �����___________����Ӧ ����
�����___________����Ӧ ����![]() ������Ϊ_______________
������Ϊ_______________
(3)��֪�������������pH���±�����Ӧ���к���ʱ���ð�ˮ��pH�ķ�Χ��______________��
���� |
|
|
|
��ʼ����pH |
|
|
|
��ȫ����pH |
|
|
|
(4)������Һ�����Ƿ���![]() ����Ҫ���Լ��ǣ�______________
����Ҫ���Լ��ǣ�______________
(5)�ٷ�Ӧ������������![]() �����ӷ���ʽ��______________
�����ӷ���ʽ��______________
�ڷ�Ӧ������Ӧ�Ļ�ѧ����ʽ��______________________________
(6) CuCl�Ķ�������
����1.ȡ��Ʒ0.7500g��30.0mL 1.0mol��L��1������FeCl3��Һ����250mL����ƿ�У�����ҡ����
����2.����Ʒ�ܽ��ƽ����Ϊ3�ݣ���0.1000mol��L��1 Ce(SO4)2����Һ���еζ���
����ʵ�����������±�
��� | 1 | 2 | 3 |
��ʼ���� |
|
|
|
�յ���� |
|
|
|
��֪��![]() ��
��![]() ��
��
�����ݴ����������CuCl�Ĵ���Ϊ_________![]()
��������в�����ʹ�ⶨ���ƫ�ߵ���______________
A.��ƿ������������ˮ
B.�ζ��յ����ʱ���ӵζ��̶ܿ���
C.0.1000mol��L��1��������Һ���ú�Ũ�ȱ�С
D.�ζ�ǰ�ζ��ܼ��������ݣ��ζ����������
E.����Ͳȡ10.0mL 1.0mol��L��1��![]() ��Һʱ���ӿ̶���
��Һʱ���ӿ̶���