题目内容
将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐渐加入浓度为amol/L的HCl溶液,反应过程中先有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干灼烧得固体w2g.下列关系式中正确的是
| A.n(Na)+3n(Al)=2V1/22.4 | B.aV2=V1/22.4 |
| C.35.5aV2=w2-w1 | D.35.5aV2>(w2-w1) |
AD
解析试题分析:2Na+2H2O=2NaOH+H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑。由于金属没有剩余,所以n(Na)≥ n(Al) 。根据电子守恒可得n(Na)+3n(Al)=2V1/22.4.所以A正确。向溶液中逐渐加入浓度为amol/L的HCl溶液,发生反应NaAlO2+HCl+ H2O= Al(OH)3↓+NaCl; Al(OH)3+3HCl=AlCl3+3H2O.最后得到的固体为NaCl、AlCl3。加入的HCl的物质的量为aV2mol.固体增加的质量是Cl-的质量。m(Cl-)=35.5aV2=(w2-w1)为了保证NaAlO2+HCl+ H2O= Al(OH)3↓+NaCl; Al(OH)3+3HCl=AlCl3+3H2O.反应完全,Cl-要过量,所以35.5aV2>(w2-w1) 。选项为D。因此该题目正确选项为AD。
考点:考查钠、铝的单质及化合物的性质的知识。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案有关Na2CO3和NaHCO3的叙述中正确的是
| A.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 |
| B.NaHCO3比Na2CO3热稳定性强 |
| C.Na2CO3和NaHCO3均可与澄清石灰水反应 |
| D.Na2CO3和NaHCO3均可与NaOH溶液反应 |
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下: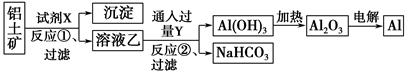
下列叙述正确的是 ( )。
| A.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
下列除去杂质的方法不正确的是( )
| A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 |
| B.用过量氨水除去Fe3+溶液中的少量Al3+ |
| C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 |
| D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
将等物质的量的镁和铝相混合,取等质量的该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )。
| A.3 mol·L-1 HCl溶液 | B.4 mol·L-1 HNO3溶液 |
| C.8 mol·L-1 NaOH溶液 | D.18 mol·L-1 H2SO4溶液 |
下列反应所得溶液中一定只含一种溶质的是( )
| A.向AlCl3溶液中滴入NaOH溶液 |
| B.向NaOH溶液中通入SO2气体 |
| C.向稀硝酸中加入过量铁粉 |
| D.向Na2CO3溶液中滴入盐酸 |
下列有关金属及其化合物的说法正确的是( )
| A.由于铝在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性能,是一种应用广泛的金属材料 |
| B.向FeCl3溶液中滴入KI—淀粉溶液,溶液变蓝色 |
| C.向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生 |
| D.装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低 |
将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
| A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变 |
| B.往溶液中滴入无色KSCN溶液,显黄色 |
| C.Fe2+和Fe3+的物质的量之比为6:1 |
| D.氧化产物与还原产物的物质的量之比为2:5 |
下列从海水中提取镁正确的方法是( )
(提示:熔点:MgO 2 850℃ MgCl2 714℃)
A.海水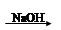 Mg(OH)2 Mg(OH)2 Mg Mg |
B.海水 MgCl2溶液→MgCl2晶体 MgCl2溶液→MgCl2晶体 Mg Mg |
C.海水 Mg(OH)2 Mg(OH)2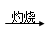 MgO MgO Mg Mg |
D.海水 Mg(OH)2 Mg(OH)2 MgCl2溶液→MgCl2晶体 MgCl2溶液→MgCl2晶体 Mg Mg |