题目内容
有关Na2CO3和NaHCO3的叙述中正确的是
| A.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 |
| B.NaHCO3比Na2CO3热稳定性强 |
| C.Na2CO3和NaHCO3均可与澄清石灰水反应 |
| D.Na2CO3和NaHCO3均可与NaOH溶液反应 |
C
解析试题分析:A、等质量的Na2CO3和NaHCO3的物质的量不同,所以与足量盐酸作用时产生的气体质量不同,错误;B、NaHCO3受热易分解,Na2CO3对热更稳定,错误;C、Na2CO3和NaHCO3均可与澄清石灰水反应生成碳酸钙沉淀,正确;D、NaHCO3可与NaOH溶液反应,Na2CO3不与NaOH溶液反应,错误,答案选C。
考点:考查Na2CO3和NaHCO3的稳定性、与酸碱的反应的比较

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐渐加入浓度为amol/L的HCl溶液,反应过程中先有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干灼烧得固体w2g.下列关系式中正确的是
| A.n(Na)+3n(Al)=2V1/22.4 | B.aV2=V1/22.4 |
| C.35.5aV2=w2-w1 | D.35.5aV2>(w2-w1) |
工业用洗净的废铜作原料来制备硝酸铜。为了节约原料和防止污染,宜采取的方法是
A.Cu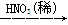 Cu(NO3)2 Cu(NO3)2 |
B.Cu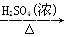 CuSO4 CuSO4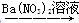 Cu(NO3)2 Cu(NO3)2 |
C.Cu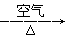 CuO CuO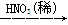 Cu(NO3)2 Cu(NO3)2 |
D.Cu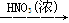 Cu(NO3)2 Cu(NO3)2 |
将一浅绿色溶液,置于空气中,变黄色。将此黄色溶液逐滴滴入沸水中,
形成一种红褐色胶体,下列说法中错误的是( )
| A.该浅绿色溶液中含有Fe2+,在空气中被氧化为Fe3+ |
| B.欲检验该黄色溶液中是否含有未被氧化的Fe2+,向其中滴加KSCN溶液 |
| C.配制该浅绿色溶液,要向其中加少量酸与铁粉,目的是为了防止Fe2+的水解与氧化 |
| D.欲检验浅绿色溶液中是否含有Fe3+,滴入KSCN溶液,看是否变红色 |
关于化合物xNa2CO3·yH2O2的推理不正确的是( )
| A.若1 mol该化合物受热完全分解后余下固体212 g ,则x=y=3 |
| B.若向其滴加稀硫酸有无色气体生成,则该气体可能含有O2和CO2 |
| C.若向其新制溶液中滴加酸性高锰酸钾溶液后褪色,则其溶液具有还原性 |
| D.若向其新制溶液中滴加酚酞后溶液先变红后褪色,则其溶液具有碱性和漂白性 |
新型镁合金被大量应用于制笔记本电脑的外壳、竞赛自行车的框架等,这些实际应用充分体现了镁合金的下列哪些优异性能( )
①熔点低;②硬度大;③延展性好;④导电性强;⑤密度小;⑥耐腐蚀
| A.①②③ | B.②③④ | C.①③⑥ | D.②⑤⑥ |
属于联合制碱法优点的是( )。
| A.氨和二氧化碳由合成氨厂提供 | B.母液可回收氯化铵 |
| C.氯化钠的利用率达90%以上 | D.以上全是 |
铝用来焊接钢轨是利用( )。
| A.铝同氧气反应生成稳定的保护层 |
| B.铝是热的良导体 |
| C.铝是强还原剂,铝热反应放热 |
| D.铝合金强度大 |
根据下列框图分析,下列说法正确的是( )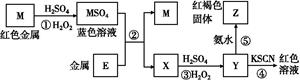
| A.E3+的氧化性比M2+的氧化性弱 |
| B.在反应①中硫酸既表现了酸性、又表现了氧化性 |
C.反应④的离子方程式可表示为:3SCN-+E3+ E(SCN)3↓ E(SCN)3↓ |
| D.在③反应中若不加稀硫酸可能看到红褐色沉淀 |