题目内容
14.设NA为阿伏彻德罗常数的值.下列说法错误的是( )| A. | 0.5mo1H20含有的原子数目为1.5NA | |
| B. | 3.6g石墨和C60的混合物中,含有的碳原子数为0.3NA | |
| C. | 含有4.6g钠元素的过氧化钠和氯化钠的混合物中.所含离子总数为0.3NA | |
| D. | 0.5NA个氯分子的物质的量是0.5mol |
分析 A、水为三原子分子;
B、石墨和C60均由碳原子构成;
C、钠离子的物质的量n=$\frac{4.6g}{23g/mol}$=0.2mol,而无论在氧化钠还是在过氧化钠中,均为2mol钠离子~1mol阴离子,据此分析;
D、根据物质的量n=$\frac{N}{{N}_{A}}$来计算.
解答 解:A、水为三原子分子,故0.5mol水中含1.5mol原子即1.5NA个,故A正确;
B、石墨和C60均由碳原子构成,故3.6g混合物中含有的碳原子的物质的量n=$\frac{3.6g}{12g/mol}$=0.3mol,个数为0.3NA个,故B正确;
C、钠离子的物质的量n=$\frac{4.6g}{23g/mol}$=0.2mol,而在过氧化钠中,2mol钠离子~1mol阴离子,但在氯化钠后,1mol钠离子~1mol阴离子,故当含有0.2mol钠离子时,含有的阴离子介于0.1mol~0.2mol之间,故离子总数介于0.3NA~0.4NA之间,故C错误;
D、物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
4.已知二氧化氮与氨气在一定条件下反应可以生成氮气和水,有关该反应的判断中正确的是( )
| A. | 氨气在反应中得到电子,表现还原性 | |
| B. | 有1molN2生成时,反应中转移电子数为6NA | |
| C. | 氧化产物与还原产物的质量之比为4:3 | |
| D. | 该反应中各物质均属于非电解质 |
5.某溶液中加入铝粉产生H2,则该溶液中一定大量存在的下列离子组是( )
| A. | K+、Na+、Cl-、NO3- | B. | Mg2+、K+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | K+、Na+、Cl-、SO42- |
2.已知阿伏加德罗常数的值为NA.下列说法正确的是( )
| A. | 28gN2与足量氢气反应,转移电子的数目为6NA | |
| B. | 标准状况下,11.2LHF含有的分子数为0.5NA | |
| C. | 标准状况下,22.4L14CO2与44g14CO2所含分子数均为NA | |
| D. | 2L0.2mol•L-1的稀硝酸与适量铁恰好反应(还原产物只有NO),生成NO的分子数为0.1NA |
9.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g);
(1)判断反应达到平衡状态的依据是cd(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等 b. 混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2}).c(CO)}$,△H<0(填“>”、“<”或“=”).
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/c(CH3OH)减小
④某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L•min).
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”);
(4)已知在常温常压下: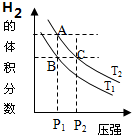
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1 .
(1)判断反应达到平衡状态的依据是cd(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等 b. 混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/c(CH3OH)减小
④某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L•min).
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”);
(4)已知在常温常压下:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1 .
3.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见表:
实验流程如下:
C6H12O6溶液$→_{①}^{滴加3%溴水/55℃}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{趁热过滤}$$→_{④}^{乙醇}$ 悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$ Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,如图装置最适合的是:B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液 C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率,便于后续分离;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
C6H12O6溶液$→_{①}^{滴加3%溴水/55℃}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{趁热过滤}$$→_{④}^{乙醇}$ 悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$ Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,如图装置最适合的是:B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液 C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率,便于后续分离;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
10. 正丁醚(C4H9OC4H9)是惰性溶剂,常用作有机合成反应溶剂.某实验小组利用如图装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$ C4H9OC4H9+H2O
正丁醚(C4H9OC4H9)是惰性溶剂,常用作有机合成反应溶剂.某实验小组利用如图装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$ C4H9OC4H9+H2O
实验步骤:在一定容积的三劲烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接仪器A.先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三劲烧瓶放在石棉网上小火加热至微沸,进行反应.反应中产生的水经A后,收集在分水器的下层,上层有机层相积至分水器支管时,即可返回三劲烧瓶.大约经1.5h后,三劲烧瓶中反应液温度可达134-136℃,当分水器全部被水充满时停止反应,将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.反应物和产物的相关数据列表如下:
回答下列问题:
(1)仪器A的名称是冷凝管.
(2)合成粗产品时,液体试剂加入顺序是先加入正丁醇,再加入浓硫酸.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,分液漏斗使用前需要检漏并洗净,分液时有机层在分液漏斗的上(填“上”或“下”)层.
(4)本实验中溶液产生的有机副产物是1-丁烯,其与溴水反应的化学反应方程式为:CH2=CHCH2CH3+Br2→BrCH2CHBrCH2CH3.
(5)有机层粗产物依次用12mL水、8mL5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸;洗涤完成后,通过以下操作分离提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏b.过滤c.加入无色CaCl2
(6)本实验所得到的正丁醚产率为35.34%(保留小数点后两位).
 正丁醚(C4H9OC4H9)是惰性溶剂,常用作有机合成反应溶剂.某实验小组利用如图装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$ C4H9OC4H9+H2O
正丁醚(C4H9OC4H9)是惰性溶剂,常用作有机合成反应溶剂.某实验小组利用如图装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$ C4H9OC4H9+H2O实验步骤:在一定容积的三劲烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接仪器A.先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三劲烧瓶放在石棉网上小火加热至微沸,进行反应.反应中产生的水经A后,收集在分水器的下层,上层有机层相积至分水器支管时,即可返回三劲烧瓶.大约经1.5h后,三劲烧瓶中反应液温度可达134-136℃,当分水器全部被水充满时停止反应,将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.反应物和产物的相关数据列表如下:
| 药品名称 | 性态 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 液体 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 液体 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注 | 正丁醇易溶于饱和氯化钙溶液中,而正丁醚微溶 | ||||
(1)仪器A的名称是冷凝管.
(2)合成粗产品时,液体试剂加入顺序是先加入正丁醇,再加入浓硫酸.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,分液漏斗使用前需要检漏并洗净,分液时有机层在分液漏斗的上(填“上”或“下”)层.
(4)本实验中溶液产生的有机副产物是1-丁烯,其与溴水反应的化学反应方程式为:CH2=CHCH2CH3+Br2→BrCH2CHBrCH2CH3.
(5)有机层粗产物依次用12mL水、8mL5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸;洗涤完成后,通过以下操作分离提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏b.过滤c.加入无色CaCl2
(6)本实验所得到的正丁醚产率为35.34%(保留小数点后两位).
8.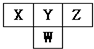 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | Z元素的最高价氧化物的水化物的酸性最强 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |

