题目内容
11. 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 正反应是放热反应a>b | B. | 正反应是吸热反应a<b | ||
| C. | 正反应是吸热反应a>b | D. | 正反应是放热反应a<b |
分析 由图象曲线的变化特点可知,升高温度,G的体积分数减小,说明升高温度平衡向正反应方向移动,说明该反应的正方向为吸热反应;增大压强,G的体积分数增大,则平衡向生成G的方向移动,说明a<b.
解答 解:由图象曲线的变化特点可知,升高温度,G的体积分数减小,说明升高温度平衡向正反应方向移动,说明该反应的正方向为吸热反应;增大压强,G的体积分数增大,则平衡向生成G的方向移动,说明a<b,
故选B.
点评 本题考查化学平衡移动,难度不大.注意分析曲线变化特点,从温度和压强的变化的趋势进行分析判断.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
1.现有容积均为500mL的甲、乙两个密闭容器(甲容器恒温恒容,乙容器恒容绝热),500℃时向两容器中分别充入1mol N2和2.5mol H2,发生反应:N2+3H2═2NH3△H<0并达到平衡.下列有关说法不正确的是( )
| A. | 达平衡后,甲、乙两容器中气体的密度相同 | |
| B. | 甲容器中反应达平衡所需时间比乙容器中的长 | |
| C. | 达平衡后,甲容器中混合气体的平均摩尔质量比乙容器中的大 | |
| D. | 平衡时甲容器中c(N2)=1 mol/L,若再充入1.5 mol N2和1 mol NH3,H2的转化率变大 |
2.若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是( )
| A. | 该元素原子核外共有4个电子层 | |
| B. | 该元素原子最外层共有3个电子 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
19.下列物质与危险化学品标志的对应关系正确的是( )
| A. |  氯化钠 | B. |  乙醇 | C. |  木炭 | D. |  氢氧化钠 |
20.下列说法正确的是( )
| A. | 反应C(s)+CO2(g)=2CO(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g),△H=+56.76 kJ/mol,自发进行的原因熵增大效应大于能量效应 | |
| C. | 恒温时,向水中加入少量固体硫酸氢钠,水电离的c(H+)减小,水的离子积常数Kw减小 | |
| D. | 2CO(g)+2NO(g)=N2(g)+2CO2(g)在298K时能自发进行,则它的△H>0,△S>0 |
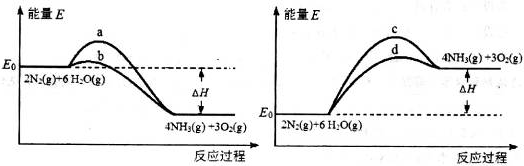
 (1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
(1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1