题目内容
向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3-t4阶段为使用催化剂,t5-t6 阶段为升高温度,图一中t0-t1阶段c(B)未画出.
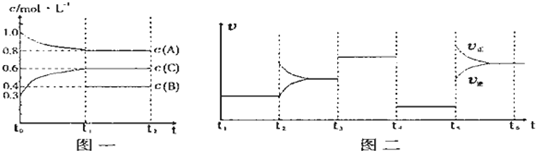
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=
(2)t4-t5阶段改变的条件为
(3)此反应的化学方程式可表示为
(填“放”或“吸”)热反应.
(4)各阶段平衡时对应的平衡常数如下表所示:
则K1=

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=
0.02mol/(L?min)
0.02mol/(L?min)
.(2)t4-t5阶段改变的条件为
减小压强
减小压强
,B的起始物质的量为1.0mol
1.0mol
.(3)此反应的化学方程式可表示为
2A(g)+B(g) 3C(g)
3C(g)
 3C(g)
3C(g)2A(g)+B(g) 3C(g)
3C(g)
,该反应为 3C(g)
3C(g)吸
吸
(填“放”或“吸”)热反应.
(4)各阶段平衡时对应的平衡常数如下表所示:
| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
0.84
0.84
(保留两位小数),K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5
K1=K2=K3=K4<K5
(用“>”、“<”或“=”连接)分析:本题以图象的形式考查影响化学反应速率以及化学平衡移动的因素.
(1)根据v=
计算v(C);
(2)(3)图二是在四种不同情况下影响化学的平衡,而影响平衡的因素有:浓度、温度、压强、催化剂.
t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应.
t3~t4的平衡比原平衡的速率要快,而t4~t5的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t4~t5段为减压.
反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,
写出该反应的方程式为2A(g)+B(g) 3C(g).起始2molA所对应的浓度为1mol/L,则体积应是2L.
3C(g).起始2molA所对应的浓度为1mol/L,则体积应是2L.
t5-t6 阶段为升高温度,v(正)>(逆),平衡向正反应方向移动,升高温度平衡向吸热方向移动.
(4)根据平衡常数及浓度商,平衡移动解答.
(1)根据v=
| △c |
| △t |
(2)(3)图二是在四种不同情况下影响化学的平衡,而影响平衡的因素有:浓度、温度、压强、催化剂.
t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应.
t3~t4的平衡比原平衡的速率要快,而t4~t5的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t4~t5段为减压.
反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,
写出该反应的方程式为2A(g)+B(g)
 3C(g).起始2molA所对应的浓度为1mol/L,则体积应是2L.
3C(g).起始2molA所对应的浓度为1mol/L,则体积应是2L.t5-t6 阶段为升高温度,v(正)>(逆),平衡向正反应方向移动,升高温度平衡向吸热方向移动.
(4)根据平衡常数及浓度商,平衡移动解答.
解答:解:(1)15min内,以C浓度变化表示的反应速率为v(C)=
=
=0.02 mol/(L?min).
故答案为:0.02 mol/(L?min);
(2)t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应.
t3~t4的平衡比原平衡的速率要快,而t4~t5的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t4~t5段为减压.
反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,
该反应的方程式为2A(g)+B(g) 3C(g),所以,△c(B)=
3C(g),所以,△c(B)=
△n(A)=
×0.2mol/L=0.1mol/L,起始2molA所对应的浓度为1mol/L,则体积应是
=2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)×2L=1mol.
故答案为:减小压强 1.0mol
(3)由(2)可知该反应的方程式为2A(g)+B(g) 3C(g),t5-t6 阶段为升高温度,v(正)>(逆),平衡向正反应方向移动,升高温度平衡向吸热方向移动,所以,该反应为吸热反应.
3C(g),t5-t6 阶段为升高温度,v(正)>(逆),平衡向正反应方向移动,升高温度平衡向吸热方向移动,所以,该反应为吸热反应.
故答案为:2A(g)+B(g) 3C(g);吸
3C(g);吸
(4)t1-t2段,处于平衡状态,c(A)平衡=1mol/L,c(B)平衡=0.4mol/L,c(C)平衡=0.6mol/L,
K1=
=
=0.84
t2-t3段,为改变浓度,平衡移动,平衡常数不变,K2=0.84
t3-t4段,使用催化剂,加快反应,平衡常数不变,K3=0.84
t4-t5段,为降低压强,反应速率降低,平衡不移动,平衡常数不变,K4=0.84
t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,
故 K1=K2=K3=K4<K5
故答案为:0.84 K1=K2=K3=K4<K5
| △c(C) |
| △t |
| (0.6-0.3)mol/L |
| 15min |
故答案为:0.02 mol/(L?min);
(2)t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,因此应该推断该反应为等体积变化的反应.
t3~t4的平衡比原平衡的速率要快,而t4~t5的速率又变慢,则前者应是加催化剂,因为条件只能用一次,t4~t5段为减压.
反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,
该反应的方程式为2A(g)+B(g)
 3C(g),所以,△c(B)=
3C(g),所以,△c(B)=| 1 |
| 2 |
| 1 |
| 2 |
| 2mol |
| 1mol/L |
故答案为:减小压强 1.0mol
(3)由(2)可知该反应的方程式为2A(g)+B(g)
 3C(g),t5-t6 阶段为升高温度,v(正)>(逆),平衡向正反应方向移动,升高温度平衡向吸热方向移动,所以,该反应为吸热反应.
3C(g),t5-t6 阶段为升高温度,v(正)>(逆),平衡向正反应方向移动,升高温度平衡向吸热方向移动,所以,该反应为吸热反应.故答案为:2A(g)+B(g)
 3C(g);吸
3C(g);吸(4)t1-t2段,处于平衡状态,c(A)平衡=1mol/L,c(B)平衡=0.4mol/L,c(C)平衡=0.6mol/L,
K1=
| c3(C) |
| c2(A)c(B) |
| (0.6mol/L)3 |
| (0.8mol/L)2(0.4mol/L) |
t2-t3段,为改变浓度,平衡移动,平衡常数不变,K2=0.84
t3-t4段,使用催化剂,加快反应,平衡常数不变,K3=0.84
t4-t5段,为降低压强,反应速率降低,平衡不移动,平衡常数不变,K4=0.84
t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,
故 K1=K2=K3=K4<K5
故答案为:0.84 K1=K2=K3=K4<K5
点评:本题以图象的形式考查影响化学反应速率以及化学平衡移动的因素,题目难度中等,注意分析条件改变对化学平衡移动的影响,为本题的难点,易错点,也是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
