题目内容
在密闭容器中,将2.0molCO与10molH2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g) K=1.0
①该反应的平衡常数表达式是:
②CO转化为CO2的转化率为:
| 催化剂 |
①该反应的平衡常数表达式是:
| c(CO2)?c(CO2) |
| c(CO2)?c(CO2) |
| c(CO2)?c(CO2) |
| c(CO2)?c(CO2) |
②CO转化为CO2的转化率为:
83%
83%
.分析:①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此生成;
②令平衡时参加反应的CO的物质的量为nmol,利用三段式表示出平衡时各组分的物质的量,由于各物质的化学计量数都是1,故可以用物质的量代替浓度,代入平衡常数计算n值,再利用转化率定义计算CO的转化率.
②令平衡时参加反应的CO的物质的量为nmol,利用三段式表示出平衡时各组分的物质的量,由于各物质的化学计量数都是1,故可以用物质的量代替浓度,代入平衡常数计算n值,再利用转化率定义计算CO的转化率.
解答:解:①、可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数表达式k=
,
故答案为:
;
②、令平衡时参加反应的CO的物质的量为nmol,则:
CO(g)+H2O(g)
CO2(g)+H2(g)
开始(mol):2 10 0 0
变化(mol):n n n n
平衡(mol):2-n 10-n n n
故
=1
解得:n=
故CO的转化率为
×100%=83.3%,
故答案为:83.3%.
| 催化剂 |
| c(CO2)?c(CO2) |
| c(CO2)?c(CO2) |
故答案为:
| c(CO2)?c(CO2) |
| c(CO2)?c(CO2) |
②、令平衡时参加反应的CO的物质的量为nmol,则:
CO(g)+H2O(g)
| 催化剂 |
开始(mol):2 10 0 0
变化(mol):n n n n
平衡(mol):2-n 10-n n n
故
| n×n |
| (2-n)×(10-n) |
解得:n=
| 5 |
| 3 |
故CO的转化率为
| ||
| 2mol |
故答案为:83.3%.
点评:本题考查化学平衡常数、化学平衡的有关计算等,难度中等,注意平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

练习册系列答案
相关题目
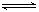 CO2(g)+H2(g) K=1.0,则CO的转化率为________
CO2(g)+H2(g) K=1.0,则CO的转化率为________  CO2(g)+H2(g) K=1.0,则CO的转化率为________
CO2(g)+H2(g) K=1.0,则CO的转化率为________