题目内容
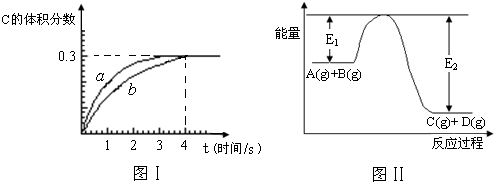
将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )


分析:A、加入催化剂降低反应的活化能,加快反应速率;
B、对于放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小;
C、缩小反应容器的体积,压强增大,反应速率增大;
D、根据反应方程式的化学计算量数关系可知,VA=VC,以此进行计算.
B、对于放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小;
C、缩小反应容器的体积,压强增大,反应速率增大;
D、根据反应方程式的化学计算量数关系可知,VA=VC,以此进行计算.
解答:解:A、加入催化剂降低反应的活化能,则E1和E2均减小,化学反应速率增大,故A正确;
B、反应物总能量大于生成物总能量,反应放热,升高温度,平衡向逆反应方向移动,平衡常数减小,故B正确;
C、缩小反应容器的体积,压强增大,反应速率增大,方程式中气体的化学计量数反应前后相等,增大压强平衡不移动,故C正确;
D、根据反应方程式的化学计算量数关系可知,VA=VC=
0.1125mol?L-1?s-1,故D错误;
故选D.
B、反应物总能量大于生成物总能量,反应放热,升高温度,平衡向逆反应方向移动,平衡常数减小,故B正确;
C、缩小反应容器的体积,压强增大,反应速率增大,方程式中气体的化学计量数反应前后相等,增大压强平衡不移动,故C正确;
D、根据反应方程式的化学计算量数关系可知,VA=VC=
| ||
| 4s |
故选D.
点评:本题考查化学平衡移动图象题,题目难度不大,注意本题反应方程式的特征,为解答该题的关键.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+2B(g)?C(g)+D(g)△H<0,C的体积分数随时间变化如图l中曲线a所示 下列说法正确的是( )
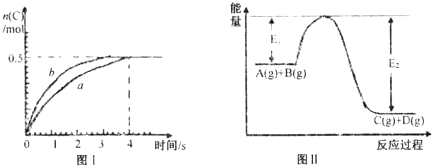

| A、此反应过程中的能量变化可用上图II表示 | B、此温度下,该反应的平衡常数的值为1 | C、该反应4s内平均速率v(A)=0.125mol?L-1?s-1 | D、若在恒温加大反应容器的容积条件下,该反应将按b曲线进行 |

 C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
 和E
和E 均减小
均减小 ·s
·s