题目内容
(12分)A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大。A、D同主族,可形成离子化合物X;B的氢化物与F的氢化物可反应生成离子化合物Y, 且B的单质是空气中含量最高的物质;C原子的最外层电子是次外层电子数的3倍;D、E、F 3种原子最外层共有11个电子, 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水。
(1)B元素的名称是________,B单质的结构式为_____________。
(2)用电子式表示化合物X的形成过程__________________________________。
(3)化合物Y的电子式为_____________,A2C2的电子式为_____________。
(4)D、E最高价氧化物的水化物之间反应的离子方程式为 ___________。
(1)B元素的名称是________,B单质的结构式为_____________。
(2)用电子式表示化合物X的形成过程__________________________________。
(3)化合物Y的电子式为_____________,A2C2的电子式为_____________。
(4)D、E最高价氧化物的水化物之间反应的离子方程式为 ___________。
(1)氮;N≡N (2)Na·+·H→Na+[:H]-
(3)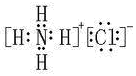 ;
; 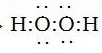 (4)Al(OH)3+OH-=AlO2-+2H2O
(4)Al(OH)3+OH-=AlO2-+2H2O
(3)
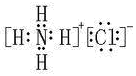 ;
; 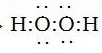 (4)Al(OH)3+OH-=AlO2-+2H2O
(4)Al(OH)3+OH-=AlO2-+2H2O试题分析:根据题意可推知这几种元素分别是A是H;B是N;C是O;D是Na;E是Al;F是Cl。(1)B元素的名称是氮;B单质的结构式为N≡N。(2)用电子式表示化合物X的形成过程为Na·+·H→Na+[:H]-。(3)化合物NH4Cl的电子式为为
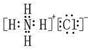 。Na2O2的电子式为
。Na2O2的电子式为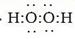 。(4)Na的最高价氧化物的水化物NaOH是强碱;、Al最高价氧化物的水化物Al(OH)3是两性氢氧化物,能跟强碱发生反应,生成盐和水。该反应的两种方程式为Al(OH)3+OH-=AlO2-+2H2O。
。(4)Na的最高价氧化物的水化物NaOH是强碱;、Al最高价氧化物的水化物Al(OH)3是两性氢氧化物,能跟强碱发生反应,生成盐和水。该反应的两种方程式为Al(OH)3+OH-=AlO2-+2H2O。
练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
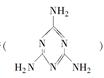 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是