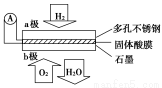
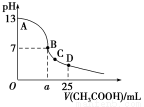
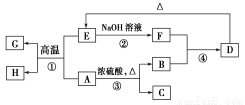
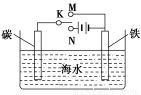
题目内容
A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数
与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4;E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:________。
(1)HClO4
(2)4.48
(3)H2O2+H2S=S↓+2H2O
(4)离子键、(极性)共价键 NaClO
(5)HSO3-+H+=H2O+SO2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
【解析】短周期元素的内层电子数可能是2或10,设B的最外层电子数为x,则x∶(2+x)=3∶4,x=6,或x∶(10+x)=3∶4,x=30,不存在,因此元素B为O;次外层电子数可能是2或8,D的次外层电子数只能为8,最外层电子数为6,因此元素D为S;相应的元素E只能是Cl,由于AE常温下为气体,A显+1价,因此元素A为H,根据C+,且原子序数介于8和16之间,得出元素C为Na。
(1)D、E的最高价氧化物对应的水化物分别是H2SO4、HClO4,由于Cl的非金属性较强,所以HClO4的酸性强于H2SO4的。(2)电解氯化钠溶液时,阳、阴两极,分别发生反应2Cl--2e-=Cl2↑、2H++2e-=H2↑,共得到0.2 mol气体,在标准状况下的体积为4.48 L。(3)A与B、A与D形成的18电子的分子分别是H2O2、H2S,两者发生氧化还原反应得到单质S。(4)乙和丙都是强电解质,可能是钠的化合物,乙抑制水的电离,可能是碱或酸,因此乙是氢氧化钠,丙是常见家用消毒剂的主要成分,应为次氯酸钠。(5)由A、B、C、D四种元素组成的两种盐可能是硫酸氢钠和亚硫酸氢钠,两者能发生反应。