��Ŀ����
����Ŀ������ѧ�Dѡ��3�����ʽṹ�����ʡ�����Se����һ���п��������������õ�Ԫ�أ������γɶ��ֻ����
��1����̬��ԭ�ӵļ۲�����Ų�ͼΪ___________��
��2���ࡢ�顢���ĵ�һ�����ܴ�С����Ϊ_____________������Ԫ�ط��ű�ʾ��
��3��SeO32-������ԭ���ӻ�������___________��SeO32-�����幹����_____________����SeO32-��Ϊ�ȵ���ķ����У�дһ�����ʵĻ�ѧʽ���ɣ�_____________��
��4��H2Se����___________������Ի�Ǽ��ԣ����ӣ��Ƚ�H2O��H2Se�ķе�ߵͣ�H2O_________H2Se������>����<������=��������ԭ����_____________�����������۵�Ϊ217�� ��������____________���塣
��5������п��һ����Ҫ�İ뵼����ϣ��侧���ṹ��ͼ��ʾ���þ�������ԭ�ӵ���λ��Ϊ_________�����þ����ܶ�Ϊpg��cm-3������п��Ħ������ΪMg/mol��NA���������ӵ�������������aΪ_______pm��

���𰸡���1��![]() ����2��As>Se>Ge��
����2��As>Se>Ge��
��3��sp3����������1�֣���CCl4����SiF4����1�֣���
��4�����ԣ�1�֣���>��1�֣���ˮ����֮���������1�֣������ӣ�1�֣���
��5��4��1�֣���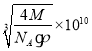
��������
�����������1����Ϊ34��Ԫ�أ���6���۵��ӣ��������ļ۲�����Ų�ʽΪ4s24p4���۲�����Ų�ͼΪ![]() ��
��
��2��ͬһ�����У�Ԫ�صĵ�һ����������ԭ��������������������ƣ����ڢ�A��Ԫ�ص�һ�����ܴ�������Ԫ�أ�����Ge��As��Se����Ԫ�صĵ�һ�����ܵĴ�С˳���ǣ�As��Se��Ge��
��3��SeO32-������ԭ�ӵļ۲���Ӷ���Ϊ![]() ����6+2��=4������Se�ӻ���ʽΪsp3�ӻ���SeO32-������ԭ��Se�ļ۲���Ӷ���Ϊ
����6+2��=4������Se�ӻ���ʽΪsp3�ӻ���SeO32-������ԭ��Se�ļ۲���Ӷ���Ϊ![]() ����6+2��=4����������һ���µ��Ӷԣ�����SeO32-�����幹���������Σ��ȵ�������ָ�۵��Ӻ�ԭ��������ȵ�������SeO42-��Ϊ�ȵ���ķ�����CCl4����SiF4����
����6+2��=4����������һ���µ��Ӷԣ�����SeO32-�����幹���������Σ��ȵ�������ָ�۵��Ӻ�ԭ��������ȵ�������SeO42-��Ϊ�ȵ���ķ�����CCl4����SiF4����
��4��H2Se�������йµ��Ӷԣ�����H2Se���ڼ��Է�����ˮ���Ӽ�������������ˮ�ķе����H2Se�ķе������������۵�Ϊ217�� ����������ڷ��Ӿ��壻
��5����������п�����ṹͼ��֪��ÿ��пԭ����Χ��4����ԭ�ӣ�ÿ����ԭ����ΧҲ��4��пԭ�ӣ�������ԭ�ӵ���λ��Ϊ4���þ����к�����ԭ����Ϊ8��![]() +6��
+6��![]() =4������пԭ����Ϊ4�����ݦѣ�
=4������пԭ����Ϊ4�����ݦѣ�![]() =
=![]() ������V=
������V=![]() �����ı߳�Ϊ
�����ı߳�Ϊ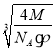 cm=
cm=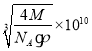 pm��
pm��

 ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�� | Ԫ�����ʻ�ԭ�ӵĽṹ |
T | 2p����ܼ���������s�ܼ���������1�� |
X | L��p�ܼ���������s�ܼ���������2�� |
Y | ��������Ԫ�صļ������а뾶��С |
Z | L����3��δ�ɶԵ��� |
��1��д��Ԫ��X�����ӽṹʾ��ͼ�� ��д��Ԫ��Z�ļ���̬�⻯��ĵ���ʽ�� ��
��2��д��Ԫ��Y������������Ӧ��ˮ������KOH��Ӧ�Ļ�ѧ����ʽ�� ��
��3��T��Y��Z����Ԫ�صĵ����л�ѧ�������Բ�ͬ���������ʵ��� ����Ԫ�ط��ţ���ͬ����Ԫ��T���Ȼ�����ȣ��ǽ����Խ�ǿ���� �����б�������֤����һ��ʵ���� ������ĸ����
a����������������ɫ��T���ʵ���ɫ��
b��T�ĵ���ͨ���Ȼ���ˮ��Һ�в����û�����
c������T�γɻ������У���Ԫ�س����ۣ�
