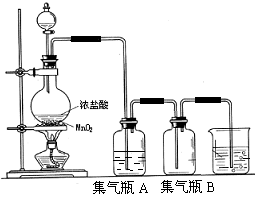
��Ŀ����
����Ŀ��
��1��ѡ����������ɱ�ʵ��������������У�������ƽ����ȷ��0.1g����ҩ�ס��ձ�����������________��________�Լ�����������Ƭ��ֽ��
��2�����㣮���Ƹ���Һ��ȡNaCl����_________g��
��3������������ƽ��ƽ֮��Ӧ����ƽ���������ij��λ�ã�����ͼ1����һ�����߱���������Ե������λ�ã�

������������NaCl����Ӧ������ƽ��________��������������������������
��������ϣ���ҩƷ�����ձ��У�
��4���ܽ⡢��ȴ���ò�ʵ������Ҫʹ�ò�������Ŀ����__________��
��5��ת�ơ�ϴ�ӣ���ת��ʱӦʹ��________��������Ҫϴ���ձ�2��3����Ϊ��________��
��6�����ݣ�ҡ�ȣ�
��7������õ���Һ����һ��ʱ�����ָ�����Լ�ƿ�������ñ�ǩ��ע�����Ƶ�ʱ�䡢________��________��
��8�������ƹ����У�ijѧ���۲춨��ʱҺ�������ͼ2��ʾ��������Һ��Ũ�Ȼ�________������ƫ��������ƫ����������Ӱ��������
���𰸡���1��500mL����ƿ��ͷ�ιܣ�2��14.6
��3�����̣�4�����裬����NaCl�ܽ�
��5������������֤����ȫ��ת��������ƿ�У�7��Ũ������ƫ��
�������������������1������һ�����ʵ���Ũ�ȵ���Һ��Ҫ�õ�������ƽ����Ͳ�����ձ���������������ƿ����ͷ�ιܣ�����ƿ�Ĺ����100mL��250mL��500mL��1000mL�������Ҫ500mL����ƿ�ͽ�ͷ�ιܣ�
��2����Ҫ�Ȼ��Ƶ�����Ϊm��NaCl����500��10��3��0.5��58.5g=14.6g��
��3������������ƽ��ʹ����������������֪NaCl���������ƽ�����̣�
��4���ܽ�ʹ�ò��������н��裬�����Ȼ��Ƶ��ܽ⣻
��5��ת��ʱӦʹ�ò�������������ֹ��Һ�������棬�������Ũ�Ȳ�����Ҫϴ���ձ��Ͳ�����2��3�Σ�Ϊ�˱�֤����ȫ��ת��������ƿ�У�
��7������õ���Һ����һ��ʱ�����ָ�����Լ�ƿ�������ñ�ǩ��ע�����Ƶ�ʱ�䡢Ũ�ȡ����ƣ�
��8�����Ӷ�����������Һ����������ʵ����ʵ������䣬���Ũ�Ƚ�ƫ�͡�